PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN
Jornada REGLAMENTO 2017/746 SOBRE PRODUCTOS SANITARIOS IVD 4 y 5 Abril by @AEFI_es & @FENIN_es
JORNADA REGLAMENTO EUROPEO 2017/746 SOBRE LOS P.S. PARA DIAGNOSTICO IN VITRO
REFLEXIÓN Y PRIMEROS PASOS PARA LA ADAPTACIÓN Barcelona 4 Abril 2018 – Madrid 5 Abril 2018 – 9h a 18h
Jornada organizada por AEFI (Asociación Española de Farmacéuticos de la Industria) y FENIN (Federación española de empresas de Tecnología Sanitaria) con la participación de Claire Murphy de Tecno-med Ingenieros. read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
@FENIN_es y AUTOCONTROL establecen el sello «AUTOCONTROL-FENIN» para la publicidad de tecnologías sanitarias
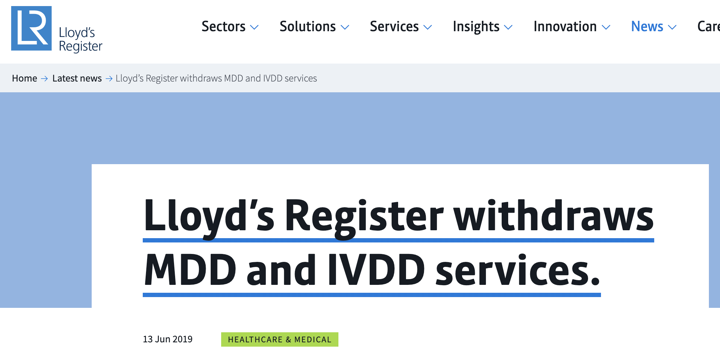
Organismos Notificados: causa baja Lloyds LRQA @LRQA NB 0088
Según anuncia en su web, LRQA ha tomado la decisión comercial estratégica de discontinuar estos servicios. También ha retirado la solicitud para convertirse en un organismo notificado de la UE con sede en los Países Bajos para estos servicios y, además, no solicitara ser un organismo notificado para el reglamento de productos sanitarios (MDR) ni de diagnóstico in vitro (IVDR). No obstante, continuará proporcionando la certificación ISO 13485 y el Programa de auditoría única para dispositivos médicos (MDSAP)
mas info: https://www.lr.org/en-gb/latest-news/lloyds-register-withdraws-mdd-ivdd-services/
Mientras se mantienen NANDO invariable con los 2 ON:
Nueva ficha informativa para profesionales sanitarios de la Campaña informativa de la @EU_Growth sobre MDR e IVDR
A fin de mantener informados a todos los interesados acerca de sus funciones y responsabilidades en virtud de los nuevos Reglamentos y ayudarles a que estén listos para la fecha de aplicación, la Comisión Europea ha creado una nueva sección, denominada «Medical Devices», en el sitio web de la DG Mercado Interior, Industria, Emprendimiento y Pymes. Este portal funciona como un punto de referencia para informarse sobre los nuevos Reglamentos, pues contiene secciones dedicadas a todas las partes interesadas de la cadena de suministro de productos sanitarios y para diagnóstico in vitro.
Una amplia base de datos
El nuevo portal también contiene una amplia base de datos con documentos y sitios web con información sobre el MDR y el IVDR, además de fichas informativas, guías paso a paso y otros recursos, como imágenes para publicar en las redes sociales, anuncios e infografías, que quienes trabajan con productos sanitarios y para diagnóstico in vitropueden utilizar libremente para difundir la información entre sus miembros.
Para más información, visite la sección Medical Devices del sitio web de la DG Mercado Interior, Industria, Emprendimiento y Pymes de la UE o bien la pagina informativa de la AEMPS donde puede registrarse para recibir un boletín informativo periódico sobre la campaña.
Estos documentos están disponibles en la web de la AEMPS, en la sección de legislación de productos sanitarios, apartados A.2 y B.2 “Normativa Europea – Reglamento sobre los productos sanitarios” y en el apartado C.2 “Normativa Europea – Reglamento sobre los productos sanitarios para diagnóstico in vitro”. Las versiones en los distintos idiomas se pueden encontrar en la página web de la Comisión Europea: Internal Market, Industry, Entrepreneurship and SMEs. Sectors Medical Devices.
La Comisión Europea @EU_Commission anuncia la convocatoria de selección de paneles de expertos
La @AEMPSgob actualiza la información del Organismo Notificado 0318
Muy relevante para todos los posibles clientes, los plazos para admitir nuevos proyectos:
Reglamento productos sanitarios MDR: Falta solo 1 año – 1 year to go
MDR 26 mayo 2020 fin periodo transitorio del Reglamento (EU) 2017/745 de Productos Sanitarios
Nueva edición del Manual de Clasificación de productos sanitarios frontera ver 1.22
Esta nueva guia incluye algunos ejemplos nuevos sobre clasificación según las directivas:
7.6. Unidades de almacenamiento de desfibrilador externo automatizado (AED) – clase I por regla 12 (si es activo) o 1 (si no es activo) y esta destinado a mantener las condiciones ambientales requeridas (para poder ser cualificado como accesorio del AED)
8.32. Lubricantes destinados al alivio de la sequedad vaginal – IIa regla 5, salvo que su fabricante demuestre que este no no permanece en el cuerpo humano más de 60 minutos después de la aplicación, en cuyo caso queda como clase I
9.12. Aplicación de soporte a la decisión de medicación – es un producto sanitario si sirve al profesional para optimizar la terapia medicinal del paciente.
Aunque ya no nos esperabamos ninguna nueva edición está claro que se intenta publicar todo trabajo que estaba empezado aunque al cambiar las reglas de clasificación es de relativamente poco interés. Nótese que el énfasis esta en establecer qué dichos nuevos productos no son cualificados como productos sanitarios o accesorios de los mismos, como siempre a revisar con el nuevo Reglamento. 
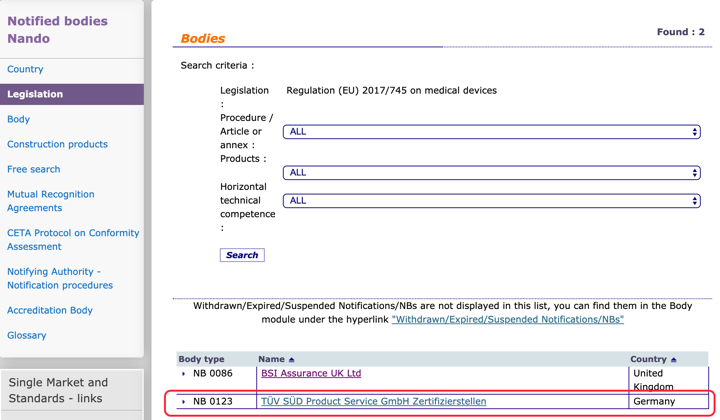
Organismos Notificados: TÜV SÜD ( @TUVSUD ) nuevo Organismo Notificado con el reglamento MDR – Enhorabuena!!
Tal y como ya os avanzamos tenemos nuevo ON para la MDR : TUV SUD
TÜV SÜD Product Service GmbH Zertifizierstellen
Ridlerstraße 65 80339 MÜNCHEN Germany
Phone : +49 (89) 50084261 Fax : +49 (89) 50084230 Email : ps.zert@tuev-sued.de
Website : http://www.tuev-sued.de/ps
podemos consultar aqui el scope : http://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=notification.pdf&dir_id=34&ntf_id=293868