PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN
Formación jornada 19 Abril 2018 Reglamento (UE) 2017/746 IVDR- Clasificación y Evaluación Conformidad de PS IVD

19 de Abril de 2018, de 10h a 18h – Parque Tecnológico BCN – C/ Marie Curie nº 8 – 08042 Barcelona
Reserva la fecha para ponerte al día e inscríbete ![]()
![]()
La entrada en vigor en Mayo 2017 del Reglamento (UE) 2017/746 sobre IVDs da un giro radical a la clasificación y evaluación de conformidad de los productos para diagnóstico in-vitro. Se prevé que la gran mayoría de productos, actualmente de autocertificación bajo la Directiva 98/79/CE, pasen ahora a precisar intervención de un Organismo Notificado para su introducción en el mercado.
Ven a conocer los plazos de transición aplicables, el nuevo sistema de Clasificación A, B, C y D basado en reglas así como los nuevos procedimientos de evaluación de conformidad.
El curso es de 1 jornada la parte presencial e incluye 25 horas (3 meses) adicionales en la web de formación http://formacion.tecnologias-sanitarias.com/course/view.php?id=97
(Precio incluye desayuno, comida, documentación, acceso portal teleformación y certificados asistencia y aprovechamiento).
Programa
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Organismos Notificados: próxima nueva designación por la Comision Europea – cuales?
![]() Según rumores en distintos medios esta próximo el nombramiento de una nueva tanda de Organismos Notificados, se habla de un grupo de 10, pero todos nos preguntamos cuales?
Según rumores en distintos medios esta próximo el nombramiento de una nueva tanda de Organismos Notificados, se habla de un grupo de 10, pero todos nos preguntamos cuales?
Os indicamos aquí los que han confirmado públicamente que estan preparados:
- 0044 TÜV NORD (web)
- 0120 SGS (web)
- 0124 DEKRA (web)
- 0197 TÜV Rheinland (web)
- 0297 DQS (web)
- 0413 Intertek (web)
- 0459 GMED (web)
- 0482 MEDCERT (web)
- 1282 Ente (web)
- 1912 DARE (web)
- 2460 DNV GL Presafe (web)
- 2658 SGS NV(web)
- 2797 BSI NL (web)
Como ya indicó la Comisión se recibieron 51 solicitudes de ON y que se designaron los dos ON más grandes (BSI y TUV SUD), esperando que se designen 20 ON antes de que finalice este año.
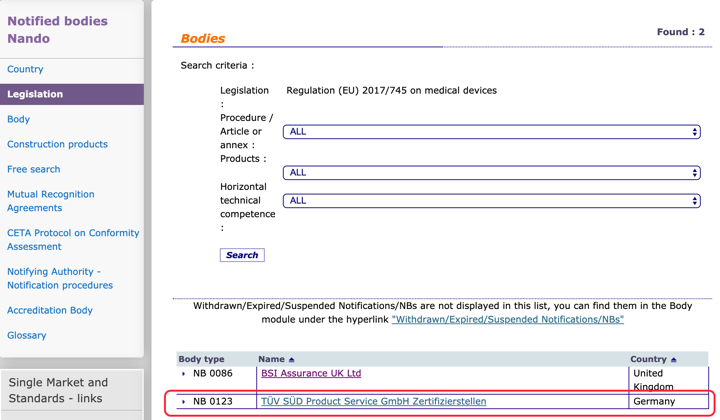
Mientras se mantienen NANDO invariable con los 2 ON:
EUDAMED – ¿Cual es la dirección web de EUDAMED?
![]()
Muchos clientes nos consultan por la dirección pública del portal de EUDAMED, es esta:
https://ec.europa.eu/tools/eudamed
Aún no esta operativa. Su fecha de puesta en marcha es marzo de 2020. read more…
Jose Luis Fernandez @ab_medica presidente de @FENIN_es Catalunya traspasa la presidencia a Marc Perez Pey @HARTMANN_Spain
Publicado borrador de las especificaciones comunes para reprocesado de productos sanitarios de un sólo uso
UDI Basico – Que es y como se calcula la letra de control (GS1)
Este es el formato del UDI-DI básico, que es un código asignado por el fabricante a un modelo o familia de producto sanitario con fines reglamentarios y que se deberá incluir en las Declaraciones UE de Conformidad con el Reglamento, que realiza el fabricante, según establece el anexo IV de MDR / IVDR. read more…
Modificación de la guia MEDDEV 2.12-1 rev.8 (2013)
nueva edición de la guia de vigilancia, para linkarlo con los nuevos formularios obligatorios a partir de Enero de 2020, e incluir los códigos de IMDRF Document IMDRF/NCAR WG/N14 FINAL:2017 (Edition 2) “Medical Devices: Post-Market Surveillance: National Competent Authority Report Exchange Criteria and Report Form”.
Formularios: https://ec.europa.eu/growth/sectors/medical-devices/current-directives/guidance_en
Guia IMDRF: http://www.imdrf.org/documents/documents.asp
El Organismo Notificado español @AEMPSgob 0318 presenta solicitud para su designación para la MDR
Sin prisa pero sin pausa continua el Organismo Notificado español AEMPS el proceso para su designación como ON para el MDR. Pese a los distintos cambios politicos y elecciones que provocan un parón en las organizaciones públicas, parece que el ON 0318 vuelve a la carga y bajo la dirección de Gloria Hernandez inicia el proceso.