PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN
Formación jornada 7 Junio 2018 Reglamento MDR- Seguimiento Postcomercialización PMS PMV PMCF y PSUR by @Tecno_med
1805 MDR – SISTEMA SEGUIMIENTO POST COMERCIALIZACIÓN (PMS, PMCF, VIG, PSUR) – 7 Junio 2018, de 10h a 18h
Parque Tecnológico BCN – C/ Marie Curie nº 8 – 08042 Barcelona
Reserva la fecha para ponerte al día e inscríbete ![]()
![]()
El 26 de Mayo de 2020 finaliza el periodo transitorio del Reglamento (UE) 2017/745 sobre productos sanitarios y se deroga la directiva 93/42/EEC (cuya transposición es el RD 1591/2009). Todos los productos sanitarios deben certificarse de nuevo con este nuevo reglamento y no hay “grandfathering” para los productos ya en el mercado, por lo que si no pasan esta nueva certificación desaparecerán del mercado. Uno de los elementos mas relevantes para pasar el examen a la primera es la obtención de evidencias de la experiencia de los productos actuales para incluir en la documentación técnica del producto sanitario. Ven a esta formación y llévate las ideas claras de que hacer.
El curso es de 1 jornada la parte presencial e incluye 25 horas adicionales en la web de formación http://formacion.tecnologias-sanitarias.com/course/view.php?id=97
(Precio incluye desayuno, comida, documentación, acceso portal teleformación y certificados asistencia y aprovechamiento).
Programa
• Definición PMS
• Relación con Gestión de Riesgos y Evaluación clínica / PMCF
• Integración en el Sistema de Gestión de la Calidad
• Papel del Organismo Notificado y de las Autoridades Sanitarias
PMS ACCIONES PROACTIVAS
• Plan seguimiento poscomercialización
• Informes rendimiento (performance) y experiencia del producto en el mercado
• Informes seguimiento clínico poscomercialización MEDDEV 2.7/1 rev4 (2016)
• Estudios PMCF MEDDEV 2.12/2
PMS ACCIONES REACTIVAS: VIGILANCIA
• Consultas técnicas. Reclamaciones
• Notificación de incidentes. MEDDEV 2.12/1
• FSCA, FSN
PMS REQUISITOS ESPECIFICOS ESPAÑA
• Requisitos Reales Decretos productos sanitarios y CCAA
• Directrices Vigilancia AEMPS
PMS REQUISITOS NUEVOS REGLAMENTOS MDR Y IVDR
• Sistema de vigilancia poscomercialización
• Plan de vigilancia poscomercialización
• Inclusión en el TF: Documentación Técnica sobre vigilancia poscomercialización (an.II bis)
• Informes periódico actualizado de seguridad PSUR
• Vigilancia de los productos (incidentes, FSCA, …). Plazos
• Inclusión en base de datos EUDAMED
– PMS y Vigilancia.
– Revisiones anuales: Informe gestión riesgos, Evaluación clínica o de funcionamiento, PMCF o PMPF y PSUR
18:00 – fin de jornada
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Consulta en IPS los datos de fabricantes e importadores españoles en @AEMPSgob
MDCG (Grupo de Coordinación de Productos Sanitarios) publica nuevas guías: vigilancia especificas de implantes mamarios y marcapasos
MDCG (Grupo de Coordinación de Productos Sanitarios) publica nueva guía: MDCG 2019-9 sobre SSCP
MDCG publica la esperada guía de una de las obligaciones para los productos sanitarios de clase III e implantes, después de 26 de mayo de 2020 que es el Resumen sobre Seguridad y Funcionamiento Clínico RSFC (siglas en inglés SSCP).
Este resumen debe ser actualizado anualmente y estará disponible públicamente en EUDAMED en los idiomas donde el producto se comercialice en Europa. Esta guia incluye un formato para estos resúmenes tanto para la versión para los profesionales como para los pacientes.
Nuevas guías FDA @FDAcdrhindustry para el software Sept-2019
La FDA renueva las guias para el software con la nueva 21st Century Cures Act que excluía de la definición de «medical device» ciertos softwares descritos en la sección 520(o).
En esta actualización se modifican la guías de nivel 2:
– General Wellness: Policy for Low Risk Devices
– Mobile Medical Applications
– Off-The-Shelf Software Use in Medical Devices
bájatelas: https://www.dropbox.com/sh/swd271x1ymofk51/AACWvcSodlT443APnkR2fPsTa?dl=0
inscríbete en nuestros cursos de FDA para mantenerte al día
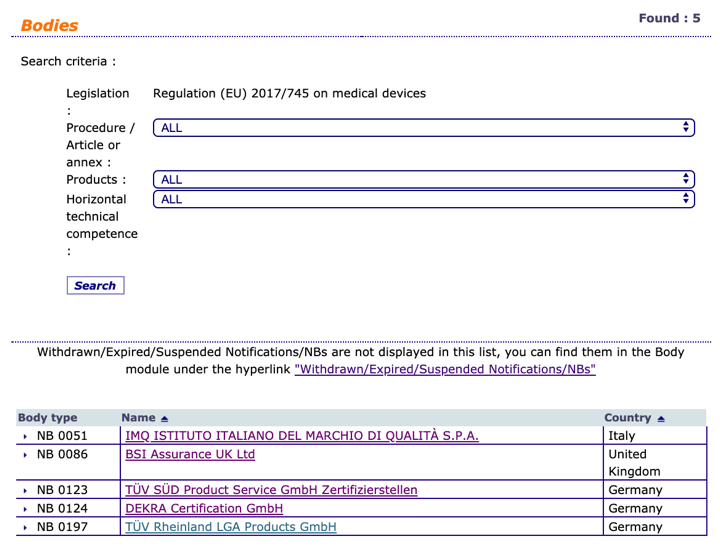
Organismos Notificados: TUV Rheinland LGA ( ON num. 0197 ) @TUV_es @TUVRheinlandNA nuevo Organismo Notificado con el reglamento MDR – Enhorabuena!!
Ya publicado en NANDO nuevo Organismo Notificado con el reglamento MDR:
TÜV Rheinland LGA Products GmbH
Tillystraße 2; 90431 Nürnberg – Germany
Tel. : +49 (0) 9116555225 Fax : +49 (0) 9116555226
Email : service@de.tuv.com
Website : www.tuv.com/safety
Orfganismo Notificado num. : 0197
Aun no tenemos a nadie para IVDR. Cada día entramos en NANDO a ver si tenemos una alegría:
Estamos retrasados con respecto a las previsiones …
TÜV SÜD @TUVSUD emite el primer certificado con el reglamento MDR a un producto clase III de Biotronik @BIOTRONIK_News – Enhorabuena!!
El ON 0123 para la MDR TÜV SÜD Product Service GmbH Zertifizierstellen Ridlerstraße 65 80339 MÜNCHEN Germany ha emitido sus dos primeros certificados para un producto de la clase III según MDR ( https://www.tuvsud.com/en/press-and-media/2019/september/first-tuv-sud-mdr-certificate-issued ) de la empresa BIOTRONIK quien también publicita el logro ( https://www.biotronik.com/en-de/newsroom/press-releases/press-release-first-mdr-sep18-en )
El inhalador Concept1 de @Novartis obtiene el primer certificado según MDR por el BSI UK Organismo Notificado 0086, enhorabuena @BSI_Iberia @NovartisSpain
El inhalador Concept1 de Novartis es el primer producto sanitario certificado según el nuevo Reglamento. Es un producto destinado a administrar medicamentos mediante inhalación (clase IIa por regla 20) que antes era clase I con la MDD y que tenia pues como fecha límite para su continuidad en el mercado el 26 de mayo de 2020.
Enhorabuena !!
BSI UK Organismo Notificado 0086 certifica el primer producto sanitario según MDR – @BSI_Iberia
BSI anuncia la certificación del primer producto sanitario según el nuevo Reglamento. Según indica BSI es un producto destinado a administrar medicamentos mediante inhalación (clase IIa por regla 20) que antes era clase I con la MDD y que tenia pues como fecha límite para su continuidad en el mercado el 26 de mayo de 2020.
Enhorabuena !!