PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formacion «2406 – REGLAMENTO MDR y R.DECRETO 192/2023 – a 3 años de su Fecha de Aplicacion» – 24 Mayo 2024 9h-11h
El 26 de mayo 2021 es la fecha de aplicación del Reglamento MDR y desde 23 de marzo de 2023 está en vigor el nuevo Real Decreto 192/2023. En esta formación revisaremos el estado actual del reglamento y RD, así como todas las novedades focalizando en el impacto de estos cambios en los distintos agentes económicos y usuarios.
No te pierdas esta jornada donde contaremos las novedades según el nuevo reglamento y Real Decreto 192/2023 para estos periodos transitorios y como verificar el cumplimiento.
Fecha: 24 Mayo 2024, 9h a 11h en webinar en directo y 13h en teleformación
Dirigido a cualquier persona del sector de productos sanitarios. Esperamos verte ahi … ![]()
[NUEVAS FECHAS] Feria @CosmobeautyBCN 16 A 18 mayo 2020 con equipos de electroestética de anexo XVI que estarán regulados por el reglamento de productos sanitarios MDR

Se celebra del 16 al 18 de mayo de 2020 la feria COSMOBEAUTY que presenta las ultimas novedades del sector de la estética y la cosmética y entre los que hay diversos productos que pasan a estar regulados como productos sanitarios. Estamos pendientes de la publicación de las Especificaciones Comunes que son obligatorias para estos productos y a partir de esta tendrán 6 meses para actualizar los productos a la nueva reglamentación. read more…
EXPOOPTICA 24-26 Abril 2020 @Expooptica ven a la formación de #FEDAO impartida por @Tecno_med
Ya se han iniciado los preparativos de EXPOOPTICA, la cita de la Optica, Optometría y la Audiología españolas que han renovado la imagen. Registrate como visitante profesional a EXPOOPTICA
Este año Tecno-med participa en las jornadas de formación de FEDAO (Federación Española de Asociaciones del Sector Óptico) con la presentación: FORMACION IMPACTO DEL REGLAMENTO (UE) 2017/745 CUYA FECHA DE APLICACION ES MAYO 2020 EN LOS PRODUCTOS DE OPTICA, CONTACTOLOGIA Y AUDIOLOGIA.
Precio: Socios de FEDAO: Formación sin coste / Profesionales y empresas del sector: 150€ + IVA
Para la reserva de plazas, por favor enviad un correo electrónico a secretaria@aeo.es indicando nombres de los asistentes, su correo electrónico y el nombre de la empresa, así como un teléfono de contacto, antes del 30 de marzo.
EXPODENTAL 2020 12 a 14 marzo – @ExpoDental_ by @FENIN_es, nos vemos allí …
EXPOOPTICA 24-26 Abril 2020 @Expooptica ven a la formación de FEDAO impartida por @Tecno_med
EXPODENTAL 2020 12 a 14 marzo – @ExpoDental_ by @FENIN_es
FELICES FIESTAS !!!
@RSNA 2019 abre sus puertas: USA Chicago #RSNA19 del 1 al 5 Dic
EXPOOPTICA 24-26 Abril 2020 @Expooptica ven a la formación de FEDAO impartida por @Tecno_med
EXPODENTAL 2020 12 a 14 marzo – @ExpoDental_ by @FENIN_es
MEDICA 2019 @MEDICAtradefair 18 a 21 Nov – ven a la jornada de divulgación de @FENIN_es HALL15 L02 el 20 Nov a las 15h contamos el UDI en 15 minutos
INFORS@LUD by @SEISeSalud 12 a 14 Marzo 2024
Nueva edición del Congreso Nacional de Informática de la Salud de la SEIS que con el lema «La cooperación como clave del éxito de la transformación digital del SNS» se celebra en Madrid del 12 al 14 de marzo de 2024.
La Inteligencia Artificial es una de las tecnologías que está recibiendo más atención a nivel mundial por su impacto potencial en el sector y la sociedad en general. Las cuestiones regulatorias son críticas para su aplicación extendida y a este fin se ha programado una sesión bajo el título de “Cooperación para el marco legal y regulador de la inteligencia artificial en salud”.
INFORSALUD es una cita imprescindible para todos los interesados en el sector de las TIC en Salud y en su contribución a la transformación sanitaria para la mejora de la calidad y a la eficiencia de los sistemas sanitarios.
#RMD2024 Conference on MD/IVD Regulatory Compliance Bruselas 26-27 Feb 2024 con la participación de @tecno_med
Magnificas jornadas donde nos encontramos con numerosos colegas españoles, se abordaron los temas mas debatidos de los reglamentos MDR e IVDR por expertos europeos, con la participación de la Comisión Europea, Medtech, EAAR, Qserve, Emergo, Obelis, Axon, Qarad, Informa y Tecno-med.
os dejamos aqui algunas fotos …

Consulta publica de la Comisión Europea sobre los reglamentos MDR/IVDR en T3 2024 – participa !!
La Comisión en su pagina web bajo el apartado «Díganos lo que piensa – Consultas públicas y comentarios» quiere conocer la opinión de las distintas partes interesadas sobre la legislación y las políticas actualmente en desarrollo. Se pueden ver los comentarios publicados o enviar sus propios comentarios.
Los Reglamentos 2017/745 y 2017/746 sobre productos sanitarios y diagnósticos in vitro tienen por objeto garantizar la disponibilidad de productos seguros y eficaces. Esto debería proteger la seguridad de los pacientes y la salud pública, aumentando al mismo tiempo la competitividad del sector y apoyando la innovación.
La evaluación específica ayudará a la Comisión a hacer balance y evaluar si las normas:
– son efectivas, eficientes y proporcionadas,
– satisfacen las necesidades actuales y emergentes,
– están en consonancia con otras acciones,
– tienen valor añadido de la UE.![]()

Jornada divulgativa #MEDICA2024 @MEDICAtradefair 21 Feb 2024 10h-11h by @FENIN_es y @accio_cat
Jornada informativa virtual sobre el programa “Servicio Expansión Salud en Europa + Medica 2024”. El objetivo del programa es apoyar a las empresas catalanas que quieran abrir mercado o consolidarse en Reino Unido, Francia y Alemania, con el fin de acceder a nuevos mercados y/o clientes y conocer más de cerca la feria Medica y la participación agrupada que ACCIÓ organizará en 2024 junto con FENIN. FENIN – Eva Sotillo Tel.: +34 91 575 98 00 E-mail: e.sotillo@fenin.es![]()
MEDICA 2024 https://www.medica-tradefair.com/
Como cada año tenemos nuestro stand en el stand agrupado de Fenin.
Formación “Regulación Medical Devices y Marcado CE» de requisitos regulatorios para ingenieros e informáticos del SAS by @FormacionSSPA impartido por @tecno_med
La legislación aplicable al equipamiento electromédico, las aplicaciones informáticas médicas y sus accesorios ha sido objeto de una actualización tanto a nivel español con el nuevo Real Decreto 192/2023 de productos sanitarios como a nivel europeo con Reglamento (EU) 2017/745 de Productos Sanitarios MDR se aplica desde 26/05/2021 quedando derogada la Directiva anterior 93 /42/CEE. En esta formación realizamos una revisión de los requisitos actuales aplicables en la comercialización de estos equipos, su adquisición, su instalación y mantenimiento y su impacto en la operación actual.
Este es el programa …
read more…
@AEFI_es de 8 a 9 mayo 2024 en Madrid – participa @tecno_med en Taller 6 (9 mayo 12h) «MARCADO CE MDSW con IA»
Como cada año tenemos una cita en el 42 SYMPOSIUM AEFI https://aefi2024.com/ este año el 8 y 9 de Mayo de 2024 en Madrid. Participamos en este magnifico encuentro de profesionales con el taller: «Marcado CE de aplicaciones informáticas médicas incluyendo Inteligencia Artificial» C.Murphy y X.Canals

Las nuevas aplicaciones IA, tanto MDR como IVDR, van a tener un efecto multiplicador de la capacidad asistencial de los profesionales sanitarios permitiendo abordar la asignatura pendiente de prevención y seguimiento de pacientes. Revisaremos en este taller como se obtiene el marcado CE de estas aplicaciones IA
No te pierdas este evento, esperamos poder saludarte allí.
Os iremos informando …

ULTIMA HORA: Propuesta ampliación periodo transitorio del IVDR: clase D 2027, clase C 2028 y clase B – Aest 2029
La proximidad de las fechas de vencimiento de los periodos transitorios ahora para IVDR, la Comisión hace una nueva propuesta de ampliación de plazos:
– 31 de diciembre de 2027, para los productos de clase D (antes mayo de 2025)
– 31 de diciembre de 2028, para los productos de clase C; (antes mayo de 2026)
– 31 de diciembre de 2029, para los productos de la clase B y clase A estériles (antes mayo de 2027).
Las nuevas fechas están sujetas al contrato con ON con anterioridad a los plazos para asegurar la jugada como en MDR:
– a más tardar el 26 de mayo de 2025, el fabricante ha establecido un sistema de gestión de la calidad;
– el fabricante o el EU-REP ha presentado una solicitud formal ante un organismo notificado, del producto o de un producto destinado a sustituirlo a más tardar el
(i) el 26 de mayo de 2025, para los productos contemplados en el apartado 3 bis y en el apartado 3 ter, letra a);
(ii) 26 de mayo de 2026, para los productos contemplados en el apartado 3 ter, letra b);
(iii) 26 de mayo de 2027, para los productos contemplados en el apartado 3 ter, letra c);
– que el organismo notificado y el fabricante hayan firmado un acuerdo escrito, a más tardar:
(i) el 26 de septiembre de 2025, para los productos clase D
(ii) 26 de septiembre de 2026, para los productos clase C;
(iii) el 26 de septiembre de 2027, para los productos clase B y A est
En breve veremos si tenemos el texto publicado en el DOUE, seguiremos informando.
Esta es la info de la Comisión Europea:
– Factsheet
– Nota de prensa
– Propuesta
– Preguntas frecuentes
Jornada Actualización en Investigación Clínica de Productos Sanitarios con MDR (presencial – online) por @fundacionEPIC 16 Enero 2024 – 10h a 14h con la participación de @AEMPSgob , @FENIN_es , @AnceiES y @MEDTECHeurope
Jornada muy interesante presencial y online organizada por Fundación EPIC a la que nos avisa Maria Aláez Directora Técnica y de Regulatory Affairs de FENIN presentando las novedades y lecciones aprendidas en las investigaciones clínicas de los productos sanitarios bajo MDR e IVDR.![]()
nos vemos en esta jornada
este es el programa read more…
Feria @Arab_Health – 29 Enero a 1 Feb 2024 Dubai #ArabHealth2024 @FENIN_es
ArabHealth como cada año va tomando mas ventaja frente a MEDICA, pero aun le queda …
En esta ocasión con 75 empresas españolas en el pabellón español con FENIN https://www.healthcaretechnologyfromspain.com/events/arab-health-2024-spanish-pavilion/
Esta es su pagina web: https://www.arabhealthonline.com/
Nos vemos allí …

Symposium AEFI 8-9 mayo 2024 by @AEFI_es en Madrid – participa @tecno_med en Taller 6 (9 mayo 12h) «MARCADO CE MDSW con IA»
Como cada año tenemos una cita en el 42 SYMPOSIUM AEFI https://aefi2024.com/ este año el 8 y 9 de Mayo de 2024 en Madrid.
Participamos en este magnifico encuentro de profesionales con el taller:
«Marcado CE de aplicaciones informáticas médicas incluyendo Inteligencia Artificial» C.Murphy y X.Canals

Las nuevas aplicaciones IA, tanto MDR como IVDR, van a tener un efecto multiplicador de la capacidad asistencial de los profesionales sanitarios permitiendo abordar la asignatura pendiente de prevención y seguimiento de pacientes. Revisaremos en este taller como se obtiene el marcado CE de estas aplicaciones IA
No te pierdas este evento, esperamos poder saludarte allí.
Os iremos informando …

26 de Mayo de 2022 es la fecha de aplicación del Reglamento (EU) 2017/746 de Productos Sanitarios para Diagnóstico in Vitro
Como ya estaba establecido en el texto original que entró en vigor el 26 de mayo de 2017, el próximo 26 de mayo de 2022 es la fecha de aplicación del Reglamento IVDR.
Consulta sobre la adecuación de la documentación que avala la conformidad de una familia de producto sanitario IVD legacy
![]()
pide nuestra asesoría en la 4-0175 Adaptación ps LEGACY IVDD a periodo de gracia
26 de Abril de 2022: falta un mes para la fecha de aplicación del Reglamento (EU) 2017/746 de Productos Sanitarios para Diagnóstico in Vitro
Como ya estaba establecido en el texto original que entró en vigor el 26 de mayo de 2017, el dia 26 de mayo de 2022 entra en vigor el Reglamento IVDR. Para poder acogerse a los periodos de gracia dependiendo de la clasificación de estos productos como fabricante se debe verificar que tenemos las evidencias de esta introducción en el mercado previa a esta fecha.
Formacion «Requisitos marcado CE(MDR), FDA y Gestión Riesgos ISO14971 de equipos y software médico en Neuroeng y Rehab» en el master «Neuroengineering and Rehabilitation» 2022 @UniBarcelona – @la_UPC – @IGuttmann impartido por @tecno_med
Este próximo 5 de mayo impartimos la sesión «Requisitos marcado CE(MDR), FDA y Gestión Riesgos ISO14971 de equipos y software médico en Neuroeng y Rehab»
Con la participación de Claire Murphy y Xavier Canals de Tecno-med Ingenieros como parte del equipo de profesores.
mas información: https://www.upc.edu/en/masters/neuroengineering-and-rehabilitation

Formación «2204 – Reglamento IVDR y RD IVD en la de fecha aplicación IVDR» – 26 Mayo 2022 9h-14h
Fecha: 26 Mayo 2022, 9h a 14h en webinar en directo y 25h en teleformación
En esta formación, conoceremos los detalles de última hora de la aplicación del IVDR y la estrategia de operación para los distintos actores
PROGRAMA
08:30 – Bienvenida: prueba de conexión y recogida de documentación
09:00 Inicio de las presentaciones.
1. Introducción. Estado
2. Fabricantes
3. Importador y EC-REP
4. Distribuidor
5. Usuarios (centros sanitarios, laboratorios clínicos, farmacias, médicos, pacientes,…)
6. Recomendaciones finales y coloquio.
Coloquio Final
14:00 – Fin de jornada![]()
El Reglamento (UE) 2017/746 (IVDR) que tiene como fecha de aplicación el próximo 26 de mayo de 2022 se complementa con el nuevo Real Decreto de productos sanitarios derogando en esta fecha la directiva 98/79/EC.
En este día tan relevante hacemos esta jornada donde queremos abordar el cambio de un modo práctico haciendo un resumen ejecutivo de estos y revisando que se espera de cada uno de nosotros según el rol que realizamos.
Así revisaremos los requisitos mas relevantes para los fabricantes, los importadores, los distribuidores, los representantes autorizados y los hospitales – laboratorios clínicos.
Veremos así las posibles estrategias y oportunidades de mercado de todos los agentes económicos y de los usuarios que van a ser los beneficiarios del cambio y esta adaptación al cambio la queremos sintetizar para vosotros con la filosofía del best-seller de S.Johnson “Quién se ha llevado mi queso”.

próxima Formación «C2203– IMPORTADORES Y DISTRIBUIDORES DE PRODUCTOS SANITARIOS SEGUN MDR/IVDR» – 29 MAR 2022 9h-14h by @tecno_med
Los reglamentos de PS refuerzan mucho los requisitos a los agentes económicos involucrados en el suministro, instalación, formación y mantenimiento de PS. En esta formación, revisaremos las nuevas obligaciones de los importadores y distribuidores de productos sanitarios así como el impacto de los requisitos del MDR en toda la cadena de suministro. Ven a esta formación eminentemente practica.
![]()

Formación «2202 -EN ISO 13485 Y REQUISITOS MDR-IVDR ANEXO IX» – 23 FEB 2022 9h-14h

Formación «2201 -ETIQUETADO E INSTRUCCIONES DE USO SEGÚN MDR / IVDR Y EN ISO 15223-1 Y EN ISO 20417» – 18 ENE 2022 9h-14h

Formación «2109 -MARCADO CE DE PRODUCTOS SANITARIOS PARA DIAGNOSTICO IN-VITRO – IVDR» – 16 DIC 2021 9h-14h
Ya estamos en la cuenta atrás final para la fecha de aplicación del nuevo reglamento IVDR – Reglamento 2017/746 y ya tenemos los primeros certificados según este. En esta formación, queremos compartir las lecciones aprendidas y analizaremos la situación actual con las últimas novedades y actualizaciones

Formación «2108 -MARCADO CE DE PRODUCTOS SANITARIOS – MDR y RD» – 14 DIC 2021 9h-14h
Se ha adoptado y ha entrado en vigor el nuevo Reglamento de Productos Sanitarios MDR. Desde 26/05/2021 se aplica quedando derogada la Directiva 93/42/CEE. En esta formación revisamos todas las novedades focalizando en el impacto de estos cambios en los procedimientos actuales de marcado CE de los productos sanitarios. Así mismo, planteamos los plazos de transición establecidos para la plena aplicación de los requisitos a lo largo de los próximos años. Incluimos la revisión de los requisitos nacionales según el RD de productos sanitarios.
Nota: la teleformacion finaliza el 30 de diciembre de 2021.![]()
Formación «2107 -EVALUACIÓN CLÍNICA E INVESTIGACIÓN CLÍNICA SEGÚN MDR y EN ISO 14155:2020» – 04 NOV 2021 9h-14h
![]()
La evaluación clínica es obligatoria para todos los productos sanitarios. La investigación clínica será prácticamente inevitable para los casos de productos implantables o de Clase III. En esta formación, revisaremos las últimas directrices MDCG y normativa aplicables, incluyendo la EN ISO 14155:2020 Good Clinical Practice, y su aplicación para cumplir las exigencias del Reglamento MDR.![]()

La @AEMPS publica el plan de trabajo para 2024
Este plan que despliega de los cinco objetivos estratégicos dentro de los cinco objetivos estratégicos descritos en su Plan Estratégico 2023-2026
Incluye elementos de gran interés para los productos sanitarios:
– Mantener el plazo medio de emisión de certificados de exportación de productos sanitarios.
– Dar respuesta a las consultas relativas a la nueva extensión de los periodos transitorios del MDR y del IVDR.
– Implementar el módulo de la aplicación informática IPS (Instalaciones de Productos Sanitarios) para la presentación de comunicaciones de fabricación de productos sanitarios in house.
– Finalizar el desarrollo del registro de comercialización en España de productos sanitarios.
– Publicar las instrucciones para la comunicación de las actividades sobre re-etiquetado de productos sanitarios
– Mantener la participación en las actividades relacionadas con productos sanitarios.
– Potenciar la participación en los siguientes foros, comités o grupos de trabajo nacionales e internacionales: Grupo ICMRA (International Coalition of Medicines Regulatory Authorities). Grupo de trabajo evidencia clínica de productos sanitarios in vitro del IMDRF (International Medical Device Regulators Forum). Grupo MDCG (Medical Devices Core Group). Grupo de desabastecimiento del CAMD (Competent Authorities of Medical Devices).
– Integrar las aplicaciones nacionales con la base de datos europea de productos sanitarios EUDAMED.
La Comisión Europea publica una encuesta sobre EUDAMED Information Centre

@COCIR ( @FENIN_es ) publica su decálogo de 5 prioridades para 2024-2029 «Priority Actions on Healthcare»
Interesante publicación que nos da la visión de la industria sobre prioridades para este lustro que empieza:
1 . Mantener el atractivo de la Unión Europea (UE) para la innovación
2. Apoyar un entorno jurídico y político adecuado a sus propósitos
3. Reconocer que el sector de la tecnología médica es fundamental para la salud de la población
4. Apoyar la competitividad del sector de las tecnologías médicas
5 . Liderar la lucha contra las enfermedades crónicas
nos encanta ver que coincidimos totalmente con este decálogo de 5 puntos …

La @CNMC_es publica su informe sobre el proyecto de Real Decreto por el que se regula la publicidad de productos sanitarios de @AEMPSgob
Siguiendo el proceso legislativo que incluye consultas a diversas entidades en general no vinculantes, la CNMC publica su informe.
En el incluye su recomendación de eliminar la venta exclusiva en farmacias de productos sanitarios IVD (ya incluida en anteriores informes y por tanto sin recorrido),
otro punto que destaca es la inclusión de la restricción de los «influencers» (usuarios de especial relevancia, como se denominan legislativamente) y advierte que están regulados también por la Ley 13/2022 General de Comunicación Audiovisual LGCA articulo 94 que establece la necesidad de una reglamentación adicional en proceso de aprobación por RD que establece los requisitos para ser considerado influencer en España. (a esperar pues la definición de influencer …)
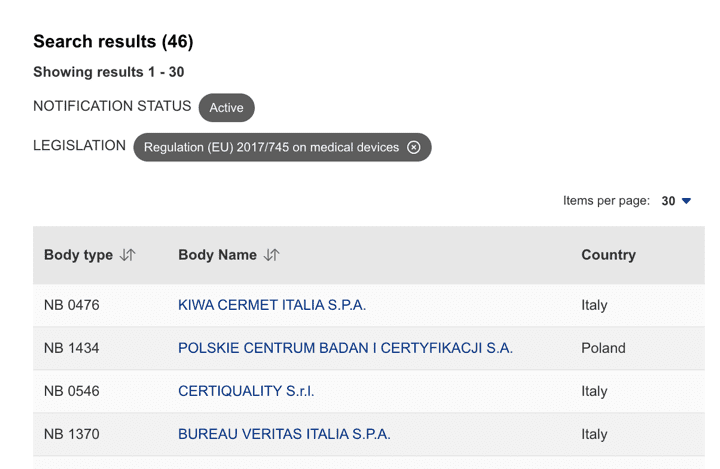
Organismos Notificados MDR (46): AFNOR CERTIFICATION (Francia) ON num. 0333 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
AFNOR Certification
11 rue Francis de Pressensé
93571 La Plaine Saint-Denis Cedex France
Tel: +33 (0)1 41 62 60 98
mail: marquage-ce@afnor.org
website: https://www.afnor.org
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://webgate.ec.europa.eu/single-market-compliance-space/#/notified-bodies/notified-body-list?filter=legislationId:34,bodyTypeId:3,notificationStatusId:1
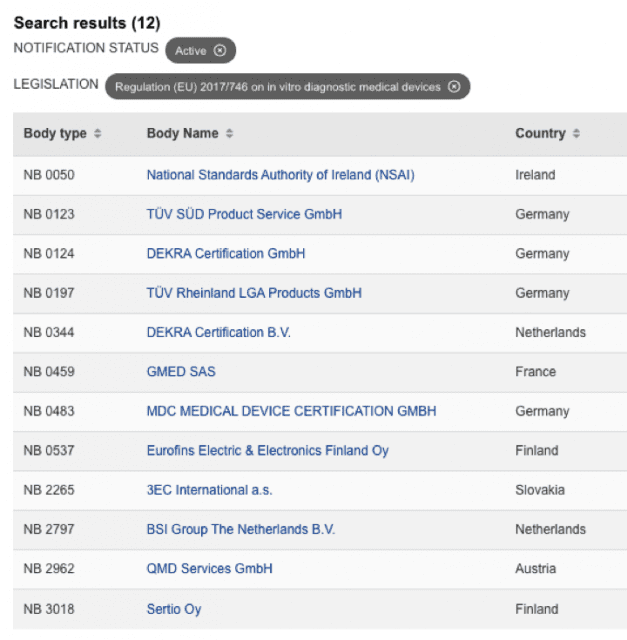
y para IVDR …
lista actualizada IVDR en:
https://webgate.ec.europa.eu/single-market-compliance-space/#/notified-bodies/notified-body-list?filter=legislationId:35,bodyTypeId:3,notificationStatusId:1

Aprobado por el Parlamento Europeo, la creación del Espacio Europeo de Datos Sanitarios ahora pasa al Consejo y después se publica entrando en vigor y se aplica a los 2 años
24 Abril 2024. El Parlamento Europeo ha respaldado la creación del EEDS (EHDS) aprobando el acuerdo interinstitucional que permitirá:
• Acceso desde cualquier país de la UE al historial médico, incluidas recetas, pruebas e imágenes médicas (basándose en la infraestructura MyHealth@EU),
• Datos sanitarios anónimos se compartirán para fines de investigación, por ejemplo, sobre enfermedades raras (muy importante para investigación)
• Sólidas salvaguardas de privacidad regularán cómo y para qué pueden compartirse datos confidenciales
No se permitirá el uso secundario con fines comerciales, incluida la publicidad, la evaluación de solicitudes de seguros o condiciones de préstamo o la toma de decisiones en el mercado laboral. Las condiciones de acceso a los datos serán tomadas por los organismos nacionales.
Próximos pasos: El Consejo adoptará ahora formalmente el Reglamento. Entrará en vigor a los 20 días de su publicación en el Diario Oficial de la Unión Europea. Su fecha de aplicación es dos años después

Boletin @AEMPSgob 1T 2024 de productos sanitarios

Publicado el Cuaderno de Buena Practica «Incorporación de la Tecnología Médica Innovadora» by Consejo Colegios Medicos Cataluña con la colaboración de @tecno_med
El Consejo de Colegios de Medicos de Cataluña ha publicado un nuevo «Quadern de Bona Praxi» de incorporación de la tecnología medica innovadora de divulgación para sus colegiados y publico general para dar a conocer los requisitos de los nuevos reglamentos de productos sanitarios MDR e IVDR aplicables a dichas aplicaciones informáticas.


La @AEMPS recibirá apoyo técnico de la CE para fortalecer su mecanismo de evaluación de tecnologías sanitarias
La AEMPS recibirá apoyo técnico de la CE para fortalecer su mecanismo de evaluación de tecnologías sanitarias, así lo comunica en su pagina web. Antes de entusiasmarnos recordemos que la definición de evaluación de tecnologías sanitarias incluye medicamentos y productos sanitarios, por lo que seguramente va mas dirigido a medicamentos. Lo veremos …