PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación webinar en directo «C2005 M-HEALTH Y SOFTWARE MEDICO SEGUN MDR» – 3 y 5 Nov 2020 by @tecno_med
Revisaremos los nuevos requisitos para las apps y software médico según los nuevos reglamentos MDR y IVDR.
3 y 5 de Noviembre de 2020, de 9h a 14h en directo y 25h en teleformacion
El curso se desarrolla en dos partes una primera en directo y otra en teleformacion en el portal web http://formacion.tecnologias-sanitarias.com/course/view.php?id=174
Reserva la fecha para ponerte al día e inscríbete
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Exito Jornada @COIIM : EL MANTENIMIENTO ELECTROMEDICO, Reflexiones tras una decada convulsa
Convocatoria elecciones SEEIC – 1 junio 2018 12h
En la próxima Asamblea General de la SEEIC el día 1 de Junio de 2018, a las 12h se celebraran elecciones para la mitad de la JD en la sede de SEEIC, Pº General Martinez Campos 9-2º, 28010 Madrid. Estas, al incluir el cargo de Presidente tienen una especial relevancia.
Deben renovarse los siguientes cargos de la Junta Directiva: Presidente (Jesus L. Manzanares Pedroche), secretario general (Francisco Javier Jimenez García- cargo que no se elige en Asamblea ya que es potestad para designarlo la nueva Junta Directiva) y Vocales de orden Impar (Jose Carlos Fernandez de Aldecoa, Antonio Manuel Ojeda Cruz y Pedro Muñoz Serrano).
Se convoca a todos los miembros de la SEEIC a presentar candidaturas individuales a los puestos de Junta Directiva de la SEEIC.
El plazo de presentación de candidaturas por correo electrónico o correo postal certificado finaliza el próximo día 29 de mayo de 2018 a las 23h59. La dirección electrónica es seeic@seeic.org y la direccion postal de la Secretaria de la SEEIC es: General Martínez Campos 9, 2º, 28010 Madrid.
Iniciadas las pruebas funcionales de la base de datos EUDAMED
 La planificación de la base de datos EUDAMED por la Comisión Europea mantiene los plazos para que no sea la “excusa” para la no aplicación de los Reglamentos y así según el plan se han realizado ya las primeras pruebas funcionales relativas a la entrada de datos por parte de los agentes económicos.
La planificación de la base de datos EUDAMED por la Comisión Europea mantiene los plazos para que no sea la “excusa” para la no aplicación de los Reglamentos y así según el plan se han realizado ya las primeras pruebas funcionales relativas a la entrada de datos por parte de los agentes económicos.
En principio habrá dos sitios web uno de acceso público y otro el accesible a las Autoridades Sanitarias, Fabricantes, EU-REP e Importadores, para subir datos a la base.
Se espera que Eudamed entre en funcionamiento en marzo de 2020, dentro del plazo requerido por el MDR. La hoja de ruta actual de los próximos pasos es la siguiente:
– 25 de mayo de 2018: MDCG acepta todas las especificaciones funcionales.
conforme al artículo 34.1 de la MDR.
– 1T 2019 En el primer trimestre de 2019 estan programadas las pruebas funcionales adicionales y en mayo de 2019 se espera que este accesible el sitio público
– Septiembre de 2019: Eudamed está listo para la auditoría formal
– Marzo de 2020: Eudamed se abre a uso rutinario.
Jornada puertas abiertas Sanidad Barcelona 7 mayo 16h45 a 19h

Lugar: Sede Subdelegación del Gobierno en Barcelona, sala de prensa. Calle Mallorca 278, 08037 Barcelona.
Jornada puertas abiertas AEMPS 10 mayo 12h15 a 14h30
Exito curso formacion ISO 13485:2016 @AENOR impartida por @CMurphy de @tecno_med
| Norma ISO 13485. Gestíón de la calidad en organizaciones de productos sanitarios — Q-77 – Presencial |

Impartido por Claire Murphy de Tecno-med Ingenieros del 26/04/2018 al 27/04/2018 en la sede de AENOR
Contenido
1. Los productos sanitarios. Delimitación del concepto
2. Legislación sobre productos sanitarios
3. Clasificación y vigilancia de los productos sanitarios:
3.1 Clasificación y marcado de conformidad
3.2. Vigilancia de los productos sanitarios
4. La Norma ISO 13485:2016
4.1 Introducción a la Norma ISO 13485
4.2 Requisitos de la Norma ISO 13485
4.3 Relación con la Norma ISO 9001
4.4 Beneficios de la aplicación de la Norma ISO 13485
5. La Norma ISO/TR 14969. Guía para la aplicación de la Norma ISO 13485
6. La implantación de un sistema de gestión de la calidad en organizaciones de productos sanitarios:
6.1 La gestión de la calidad en productos sanitarios
6.2 Requisitos generales de la gestión de la calidad en productos sanitarios
6.3 Requisitos que debe reunir la documentación
7. Casos prácticos
Exito formación de FEDAO / AEO 23 abril impartida por @Tecno_med en @optometria_cat
MUCHAS GRACIAS




read more…
seminario UB-IL3 Actualización Reglamento Productos Sanitarios – 12 Abril
REPETIMOS !!! 23 Abril ven a la formación «IMPACTO REGLAMENTO EN SECTOR OPTICA/AUDIOLOGIA» de FEDAO / AEO impartida por @Tecno_med en @optometria_cat
Dada la relevancia de los cambios en el sector debido al reglamento /EU) 2017/745 nos han pedido que repitamos la jornada en Barcelona.
Jornada @COIIM : EL MANTENIMIENTO ELECTROMÉDICO, Reflexiones tras una década convulsa

Carlos Jiménez Alonso, Academics Executive Leader en GE Healthcare y presidente de la Comisión de Ingeniería Médica y Sanitaria del COIIM nos avisa de este evento que ha organizado la comisión que preside: read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
MDCG: nueva MDCG 2021-8 Mayo-2021, apurando la cuenta atrás … investigación clínica sin EUDAMED, complementa la nota de la AEMPS
Publicada la MDCG 2021-8 «Clinical investigation application/notification documents» en ausencia de EUDAMED nos proporciona unos formularios para incluir la información que establece el reglamento MDR.
![]()
Indica también que deben revisarse las disposiciones nacionales y en España la AEMPS publicó una nota informativa en la que se establece que a partir del 5 de abril de 2021, todas las solicitudes de autorización de investigaciones clínicas enviadas a la AEMPS para su evaluación, deberán cumplir con los requerimientos del Reglamento 2017/745
Para cumplir los requerimientos del reglamento, deben seguir todo lo establecido en el capítulo VI y los Anexos XIV y XV del mismo y ahora la MDCG 2021-8

Y la nota de la AEMPS menciona algunos de los aspectos a tener en cuenta a nivel práctico:
– Hasta que se encuentre disponible la futura base de datos Europea EUDAMED, las solicitudes se realizarán de la misma forma que se hace actualmente a través del Registro General de la AEMPS.
– Las declaraciones del fabricante y del promotor del cumplimiento de los requisitos deberán hacer referencia al reglamento.
– Los AAG deben comunicarse siguiendo el documento MDCG 2020-10/1 “Safety reporting in clinical investigations of medical devices under the Regulation (EU) 2017/745.
– El tiempo de archivo de la documentación de las investigaciones clínicas con productos sanitarios no implantables será de 10 años, el de las investigaciones clínicas con productos sanitarios implantables sigue siendo de 15 años.
– En España, se van a seguir evaluando y autorizando las investigaciones clínicas con productos sanitarios en investigación de la clase I o de los productos no invasivos de las clases IIa y IIb, por lo que no aplicaría la disposición del reglamento relativa a iniciar la investigación inmediatamente después de la validación. Esto quedará reflejado en la nueva legislación que se publicará a nivel nacional.
– En España, se requerirá un dictamen favorable emitido por un Comité de Ética de Investigación con Medicamentos (CEIm), así como la conformidad de la dirección de los centros participantes para la iniciación de la misma.
– Los plazos de evaluación serán de 45 días, a partir de la fecha de validación, para todos los productos.
– El reglamento establece la obligación de llevar a cabo investigaciones clínicas con productos sanitarios de la clase III e implantables salvo excepciones con ciertos requerimientos que quedan descritos en el mismo.
![]()
MDCG: nueva MDCG 2021-7 Mayo-2021
Abierto el Servicio de Asistencia – Helpdesk de UDI Sistema de identificación única by @ComisionEuropea

Curso intensivo «Regulación de productos sanitarios bajo el nuevo reglamento 2017/745» by @FENIN_es – 2ª sesión 17 mayo 2021 – 15h30-18h
No os perdáis este curso intensivo organizado por Maria Alaez de FENIN, garantía de calidad.
El próximo 17 de mayo la segunda sesión :
15.30-16.15h Verificación y validación del diseño – Gorka Ramirez (Bexen Medical)
16.15-17.00h Evaluación clínica – David Tomé (AKRN)
17.00-17.45h Sistemas de Gestión de Calidad (QbD)
17.45-18.00h Preguntas de los asistentes
Las siguientes sesiones:
3ª SESIÓN: Día 21 mayo
15.30-16.15h Documentación Técnica – Mª Luisa Gómez de Agüero (Sedecal)
16.15-17.00h Vigilancia y seguimiento Postcomercialización – Maite Llacer Ángeles Sanfrancisco (Edwards Lifesciences)
17.00-17.45h Asignación de UDI y UDI-Básico Sergi Vilella (AECOC)
17.45-18.00h Preguntas de los asistentes
4º SESIÓN: Día 25 de mayo
15.30-16.15h Evaluación de la conformidad Gloria Hernández (Organismo Notificado 0318 AEMPS)
16.15-17.00h Base de datos EUDAMED (AEMPS)
17.00-17.45h Obligaciones de los agentes económicos para productos sanitarios certificados bajo MDR y “legacy devices” María Aláez (Fenin)
17.45-18.00h Preguntas de los asistentes

Aprobado mandato de normalización para las normas armonizadas con MDR e IVDR
Después de varios desencuentros … e.g. publicación de EN ISO 14971:2019 y EN ISO 24971:2020 sin anexos Z, el CEN y CENELEC han aceptado el mandato de armonización por lo que ya tenemos lista de normas que serán armonizadas pero que representan el estado del arte para la evaluación de conformidad con los nuevos reglamentos.

La Comisión Europea publica una propuesta de reglamento para la regulación de los métodos de Inteligencia Artificial que incluye software médico
Esta propuesta que pretende regular algo que ya esta en el mercado, llega algo tarde y veréis que el foco esta en regular el mal uso de la misma. Si que en una presentación de miembros de la Comision ya expresaron su criterio de que los software médicos ya estaban regulados y estas nuevas funcionalidades se revisarían por los Organismos Notificados como parte de la evaluación de conformidad.

Publicada online base de datos de nomenclatura de productos sanitarios EMDN que sustituye a la GMDN basada en la CND (Classificazione Nazionale dei Dispositivi medici – Italia)
En esta base de datos, https://webgate.ec.europa.eu/dyna2/emdn/ , de acceso gratuito, no solo podemos consultar los códigos sino que ademas podemos sugerir cambios. Ahora esta en inglés y en italiano. En breve en todos los idiomas de la UE cuando se haya dado por validada esta primera versión inglesa-italiana en el tercer trimestre de 2021.
Estas son las categorias de códigos: read more…

MDCG: revisión de la MDCG 2021-1 rev.1 mayo 2021 – guía de practicas y soluciones alternativas hasta que EUDAMED este en pleno funcionamiento
Publicada la revisión 1 de la MDCG 2021-1 «Guidance on harmonised administrative practices and alternative technical solutions until EUDAMED is fully functional» que indica los criterios de lo que se espera de nosotros para cumplir con los requisitos de EUDAMED antes de que este completamente funcional.
Es para eliminar un párrafo que podía inducir a error

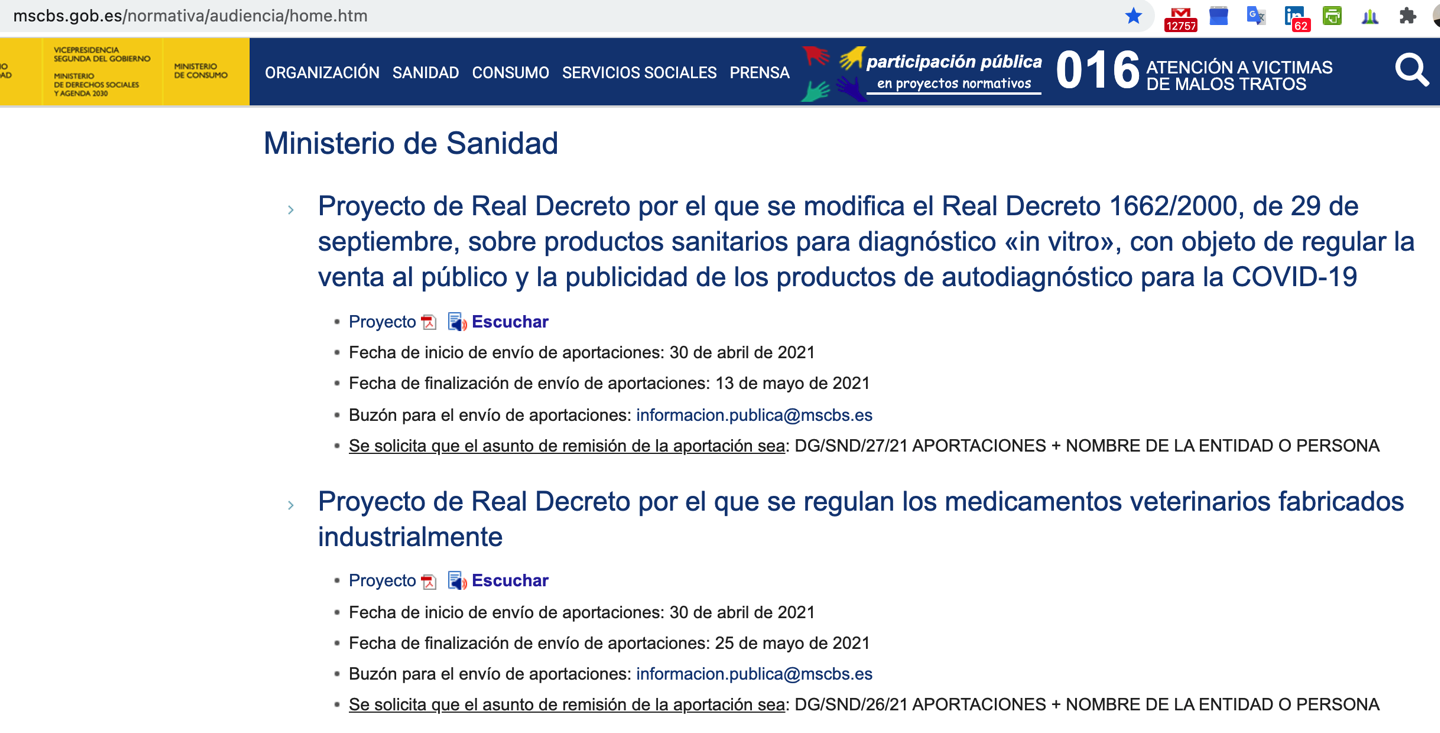
La @AEMPSgob publica un borrador del futuro Real Decreto para regular la venta al publico y publicidad de ps IVD autodiagnostico para COVID-19
La AEMPS publica el proyecto de Real Decreto modificando la venta y publicidad con productos sanitarios para IVD de autodiagnóstico en España análogamente a como han hecho otras autoridades sanitarias como las alemanas.
A destacar:
– se aplica a las pruebas de IVD de autodiagóstico (antígenos y anticuerpos) que precisan pues de intervención de Organismo Notificado
– se podrán vender en farmacia sin receta médica los test de autodiagnóstico para COVID-19
– se puede efectuar publicidad al publico de productos de autodiagnostico para COVID-19 ![]()