PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN
Formación «2101 – UDI y EUDAMED» 26 Enero 2021
Fecha: 26 Enero 2021, 9h a 14h en directo y 25h en teleformacion
Los nuevos reglamentos de productos sanitarios requieren del UDI en el etiquetado de los productos. Los plazos aplicables dependen de la clasificación del producto. No obstante precisaremos también el UDI-Básico para las declaraciones de conformidad, ciertos certificados CE y para el registro de los productos. Como fabricantes, pero también, como importadores, distribuidores y usuarios precisaremos conocer estos requisitos para registrarnos como actores en EUDAMED o consultar su contenido.
Esta es una formación desde el punto de vista regulatorio, te recomendamos que hagas una formación con GS1 Spain (AECOC http://www.aecoc.es) para la parte técnica.
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
WHO Medical Devices 13-15 Diciembre 2018 India
Premios Tecnologia y Salud 2018 – 20 Sept 19h Madrid con Mª Jesus Lamas @ChusLamas nueva Directora @AEMPSgob by @FENIN_es
Congreso de la SEIB 21-23’Nov 2018 Ciudad Real #CASEIB18 @CASEIB2018
La SEIB convoca nuevamente a participar a todos sus socios y profesionales al XXXVI Congreso de la Sociedad Española de Ingeniería Biomédica CASEIB 2018 que se celebrará los días 21 a 23 de Noviembre en el Paraninfo Luis Arroyo de la Universidad de Castilla-La Mancha en Ciudad Real. read more…
Reunión 10 septiembre de Trabajo de la MDCG (Grupo de Coordinación de Productos Sanitarios)
 Según la programación de la MDCG el próximo 10 de Septiembre se celebra la reunión de trabajo
Según la programación de la MDCG el próximo 10 de Septiembre se celebra la reunión de trabajo
Meetings of MDCG and Medical Devices Working Groups – version: 29/05/2018
http://ec.europa.eu/transparency/regexpert/index.cfm?do=groupDetail.groupDetail&groupID=3565
Reunión 30 agosto de Trabajo de la IMDRF con la participación del MDCG (Grupo de Coordinación de Productos Sanitarios)
 Según la programación de la MDCG el próximo 30 de Agosto se celebra la reunión de trabajo conjunta con la IMDRF
Según la programación de la MDCG el próximo 30 de Agosto se celebra la reunión de trabajo conjunta con la IMDRF
Meetings of MDCG and Medical Devices Working Groups – version: 29/05/2018
http://ec.europa.eu/transparency/regexpert/index.cfm?do=groupDetail.groupDetail&groupID=3565
RMD 2018 – 22 y 23 Octubre Bruselas – European Symposium on New Medical Device Regulations – Impact on Industry – The Race to Achieve Compliance by Deadline
Reunión 26 julio del Grupo de Trabajo “Software” de la MDCG (Grupo de Coordinación de Productos Sanitarios)
 Según la programación de la MDCG el próximo 26 de Julio se celebra la reunión del grupo de trabajo “Software WG”
Según la programación de la MDCG el próximo 26 de Julio se celebra la reunión del grupo de trabajo “Software WG”
Meetings of MDCG and Medical Devices Working Groups – version: 29/05/2018
http://ec.europa.eu/transparency/regexpert/index.cfm?do=groupDetail.groupDetail&groupID=3565
Jornada SEEIC 28 Sept 2018 Madrid “La seguridad en la Electromedicina e Ing Clínica: un compromiso compartido” con la participación de @XCanals
próxima jornada de SEEIC cuyo programa incluye mesas de aplicación práctica como:
– Nuevo RD y directiva 2013/59 seguridad frente exposición a radiaciones ionizantes: Aplicación a Centros Sanitarios y equipos electromédicos
– Requisitos en adquisición de electromedicina según LCSP 9/2017: Aplicación a Centros Sanitarios y equipos electromédicos
– Impresoras 3D y fabricación in-house en el hospital
En esta última Xavier Canals @XCanals contará los requisitos para esta y otras fabricaciones intrahospitalarias (in-house) que estarán reguladas por el Reglamento (EU) 745/2017 y que exigirán por ejemplo tener un sistema de calidad.
28 septiembre 2018 Clínica Universidad de Navarra Calle Marquesado de Sta. Marta, 1, 28027 Madrid ![]()
«XXIV Congreso Internacional del CEDEST» 17 al 19 octubre 2018 Málaga
Reunión 17 julio de Trabajo de la MDCG (Grupo de Coordinación de Productos Sanitarios)
 Según la programación de la MDCG el próximo 17 de Julio se celebra la reunión de trabajo
Según la programación de la MDCG el próximo 17 de Julio se celebra la reunión de trabajo
Meetings of MDCG and Medical Devices Working Groups – version: 29/05/2018
http://ec.europa.eu/transparency/regexpert/index.cfm?do=groupDetail.groupDetail&groupID=3565
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
MDCG: nueva MDCG 2021-13 FAQ de obligaciones de registro en EUDAMED para actores que no sean fabricantes, EU-REP o importadores
La Comision publica una lista de preguntas frecuentes para actores como fabricantes de ps a medida,…
Estas son las preguntas:
1. ¿Cuál es el procedimiento para registrarse como actor en EUDAMED?
2. ¿Los fabricantes de ps hechos a medida deben registrarse como actores en EUDAMED?
3. ¿Cuándo deben registrarse como actores en EUDAMED los fabricantes de solo productos a medida?
4. ¿Los fabricantes de solo dispositivos legacy tienen que registrarse como actores en EUDAMED?
5. ¿Los fabricantes de solo dispositivos «antiguos» tienen que registrarse como actores en EUDAMED?
6. ¿Los productores de paquetes de sistemas y procedimientos (SPPP) tienen que registrarse como actores en EUDAMED?
7. ¿Quién es la autoridad responsable de la aprobación de las solicitudes de registro de actores de SPPP ubicadas en países no pertenecientes a la UE?
8. ¿Cuándo se puede considerar el ID de actor como un número de registro único (SRN) de conformidad con el artículo 31 MDR y el artículo 28 IVDR?
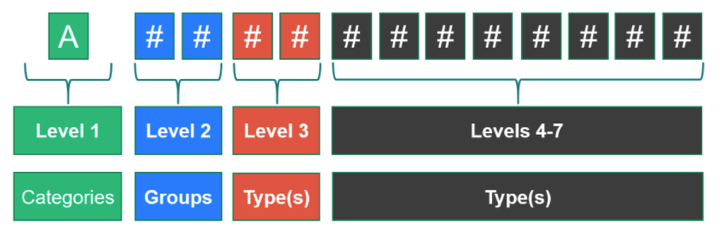
Factsheet preguntas frecuentes sobre la Nomenclatura de Productos Sanitarios Europea EMDN
La Comision nos avisa de la publicación de la primera versión de la EMDN https://webgate.ec.europa.eu/dyna2/emdn/ y nos recuerda como esta compuesto
La autoridad sanitaria de Australia TGA publica una guia de ciberseguridad para los productos sanitarios
La @AEMPSgob publica el texto del proyecto de Real Decreto por el que se regulan los productos sanitarios #MDR #medicaldevices
La AEMPS publica el esperado texto del proyecto de Real Decreto de productos sanitarios, este derogará los reales decretos1591/2009 y1616/2009![]()
El proyecto de Real Decreto comprende cuarenta y un artículos estructurados en nueve capítulos, tres disposiciones adicionales, nueve disposiciones transitorias, una disposición derogatoria y tres disposiciones finales.
Ven a nuestra formación para ver los cambios en el sistema de calidad que necesitas: https://www.tecno-med.es/?p=34694
Os iremos informando y desgranando los nuevos requisitos que como novedades incluye:
A) Establecer los requisitos y procedimientos para la regulación de los productos fabricados y utilizados en un centro sanitario (in house).
B) Establecer los requisitos y procedimientos para la regulación del reprocesamiento de productos sanitarios de un solo uso.
C) Establecer los requisitos y procedimientos para la regulación de la tarjeta de implantación.
D) Establecer la creación de un registro nacional de comercialización de productos sanitarios.
E) Regular el régimen lingüístico.
F) Establecer los requisitos para la realización de las Investigaciones clínicas en nuestro país.
G) Establecer que, en lo que respecta al Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017 sobre los productos sanitarios, la autoridad competente es la Agencia Española de Medicamentos y Productos Sanitarios, independientemente de las competencias de otras autoridades sanitarias.
MDCG: nueva MDCG 2021-11 lista de tipos de producto para incluir en la tarjeta de implante
La @MHRAdevices publica nueva guía sobre «Investigaciones clínicas con productos sanitarios: Guía para fabricantes»
Team-NB publica el «Análisis de las auditorias remotas» may 2021

MDCG: nueva MDCG 2021-12 preguntas frecuentes sobre la Nomenclatura de Productos Sanitarios Europea EMDN
La Comision nos avisa de la publicación de la primera versión de la EMDN https://webgate.ec.europa.eu/dyna2/emdn/ y nos recuerda como esta compuesto

Ya disponible para su descarga la base de datos de nomenclatura de productos sanitarios EMDN
En esta base de datos, https://webgate.ec.europa.eu/dyna2/emdn/ , de acceso gratuito, no solo podemos consultar los códigos sino que ademas podemos sugerir cambios. Ahora esta en inglés y en italiano. En breve en todos los idiomas de la UE cuando se haya dado por validada esta primera versión inglesa-italiana en el tercer trimestre de 2021.
Este es el excel de la lista completa de 8447 códigos, frente a los 26822 de GMDN parece que aun hay trabajo