PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2106 – MARCADO CE DE INSTRUMENTACIÓN, SOFTWARE, EQUIPOS AUTODIAGNOSTICO Y NPT SEGÚN IVDR» – 28 Sept 2021 9h-14h
Los instrumentos, aplicaciones software y equipos de autodiagnóstico y NPT para IVD tienen una normativa específica distinta de la de equipos electromédicos y software médico regulados por la MDR (no hay regla 11 para el software). En esta formación, revisaremos todos los requisitos aplicables a esta tipología de productos. Aunque muchos de los instrumentos siguen siendo de autocertificación (Clase A), los instrumentos NPT (Near Patient Testing – “prueba diagnóstica en el lugar de asistencia al paciente”) se clasifican según la determinación que realizan, pasando a precisar la intervención de un Organismo Notificado en muchos casos como los de autodiagnóstico. Revisaremos estos casos de analizadores y los de autodiagnóstico además de las aplicaciones informáticas con consideración de producto sanitario para diagnóstico in vitro.
PROGRAMA
08:30 – Bienvenida: prueba de conexión y recogida de documentación
09:00 Inicio de las presentaciones.
- Intro. IVDR para analizadores y software IVD
- Autodiagnóstico vs Near Patient Testing – POC vs software IVD. Cualificación y clasificación
- Normativa y guías aplicables.
- Documentación Técnica
- Sistema de Calidad
- Licencia y Registros
- Recomendaciones finales. Lecciones aprendidas
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
MDCG (Grupo de Coordinación de Productos Sanitarios) publica nuevas guías: PRRC e Implant Cards
Master en PRODUCTOS SANITARIOS Universidad Valencia 2019-2020
Master en DIRECCION DE INDUSTRIAS DE TECNOLOGIAS MEDICAS Y SANITARIAS by @FENIN_es
Congreso ICEHTMC by AIIC Asociación Italiana de Ingenieria Clínica en la que participa la @SEEIC_spain
Exito jornada «Vigilancia de Productos Sanitarios MDR» 26 Junio 2019 Barcelona by @AEFI_es con la participación de Carmen Valls de @AEMPSgob

Magnifica jornada de AEFI que abordó los aspectos principales relacionados con la gestión de la vigilancia de los productos sanitarios. read more…
Jornada «Vigilancia de Productos Sanitarios MDR» 26 Junio 2019 Barcelona by @AEFI_es con la participación de Carmen Valls de @AEMPSgob
25 Encuentro Sector Tecnología Sanitaria 12 junio 2019 by @ESADE & @FENIN_es
Este año en el Auditorio de la Escuela de Negocios ESADE, de Barcelona, el XXV ENCUENTRO DEL SECTOR DE LA TECNOLOGIA SANITARIA tendrá el título: “TECNOLOGIA PARA VIVIR Y CURAR ENFOCADA AL PACIENTE”. 12 Junio 2019, no te lo pierdas.
Información: Sylvia Martín Tel. 932.022.002 s.martin@fenin.es
ESADEFORUM Av. Pedralbes, 60-62 08034 Barcelona read more…
@MedtechEurope ( @FENIN_es ) organiza la #MedTechWeek 3-7 junio 2019
Congreso SEEIC SEVILLA 12-14 Jun 2019 @SEEIC_spain – con la participación de @XCanals
Próximo Congreso de la SEEIC (Sociedad Española de Electromedicina e Ingeniería Clínica), abierta la página web ( https://seeic2019.es ) con interesante programa y carta de Jose Domingo Sanmartin, Presidente del Comité Organizador, se celebra en Sevilla del 12 al 14 de Junio de 2019.
En este Congreso participa Xavier Canals Vicepresidente de la SEEIC el jueves 13 de junio en la mesa de «Nuevos Reglamentos de Productos Sanitarios y Sistemas de Calidad en el Hospital». read more…
@RAPSorg «RAPS Regulatory Conference Europe 2019 Where Global Experts Meet» 13-15 May 2019 Bruselas
Erik Hansson de la Comision Europea explica el estado de la implementación de la adaptación a los nuevos reglamentos en Europa. read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Abierta la segunda tanda de convocatorias EU4Health de subvenciones para proyectos de salud publica
Se abre la convocatoria EU4Healths con 13 tópicos y 7 millones de Euros. Estos son los temas:
EU4H-2021-PJ-16 – Action grants for the Computer-aided Drug Repurposing for Cancer Therapy Project
EU4H-2021-PJ-13 – Action grants to support the implementation of best practices in community-based services for the human immunodeficiency virus (HIV) infection and acquired immunodeficiency syndrome (AIDS), tuberculosis, viral hepatitis and sexually transmitted infections
EU4H-2021-PJ-07 Action grants to support implementation of best practices on the ground with direct impact on the effort to tackle mental health challenges during COVID-19
EU4H-2021-PJ-17 Action grants to organise and collect data to understand the safety, quality and efficacy of therapies applied in the field of assisted reproduction and based on haematopoietic stem cells
EU4H-2021-PJ-11 Action grants for ‘EU Cancer Treatment Capacity and Capability Mapping’ project – Network of Comprehensive Cancer Centres
EU4H-2021-PJ-09 Action grants for the initiative ‘HealthyLifestyle4All’: promotion of healthy lifestyles
EU4H-2021-PJ-12 Action grants to create a ‘Cancer Survivor Smart Card’
EU4H-2021-PJ-06 Action grants for developing a pilot project for an EU infrastructure ecosystem for the secondary use of health data for research, policy-making and regulatory purposes
EU4H-2021-PJ-18 Action grants boosting cancer prevention through the use of the European Code against Cancer and other concerted actions
EU4H-2021-PJ-15 Action grants for ‘Cancer Diagnostic and Treatment for All’ including ‘Genomic for Public Health’
EU4H-2021-PJ-08 Action grants to support actions to improve access to human papillomavirus vaccination
EU4H-2021-PJ-14 Action grants supporting training activities, implementation, and best practices
EU4H-2021-PJ-10 Action grants to reduce liver and gastric cancers caused by infections
Realizadas las primeras inscripciones en el modulo 2-Registro UDI-producto de la base de datos EUDAMED
El módulo de alta de productos ya esta en funcionamiento y ya hemos dado de alta a los primeros productos
La puesta en marcha oficial de EUDAMED es 26 de mayo de 2022, por lo que según la MDCG 2019-4 tenemos hasta 26 de mayo de 2024 para el registro de productos MDR. A partir de esta fecha el registro formará parte de la obtención del marcado CE para el producto. Atención que desde 26 de mayo de 2021 debemos asignar estos códigos UDI a nuestros productos.
MDCG: nueva MDCG 2021-25 Aplicación de los requisitos de MDR a los productos ‘legacy’ y a los productos ‘old’
No sin polémica, la MDCG ha establecido un grupo de trabajo ad hoc relativo a las disposiciones transitorias y elabora esta guía para el resto de grupos de trabajo que ahora hace publica. Vemos que como siempre la parte jurídica realiza una interpretación de mínimos, no os extrañéis pues de ver como por ejemplo nos dicen que el PRRC aun no es necesario, aunque hay que aplicar PMS y PMV siendo este su responsable … aplicar sentido común por favor y acordaros de que los plazos transitorios son eso transitorios y hay que prepararse para lo definitivo.
Establece además las definiciones de producto «legacy» (=heredado) y old (=antiguos):
Productos «legacy» deben entenderse como productos, que, de acuerdo con el artículo 120 (3) del MDR, se introducen en el mercado después de la fecha de aplicación (DoA) del MDR y hasta el 26 de mayo de 2024 si se cumplen determinadas condiciones. Esos productos pueden ser:
– productos que sean productos de clase I con arreglo a la Directiva 93/42/CEE (MDD), para los que se elaboró una Declaración CE de Conformidad antes del 26 de mayo de 2021 y para los que el procedimiento de evaluación de la conformidad con arreglo al MDR requiere la participación de un Organismo Notificado;
– productos cubiertos por un certificado CE válido emitido de acuerdo con la Directiva 90/385/CEE (AIMDD) o el MDD antes del 26 de mayo de 2021.
Productos «old» son aquellos que se introdujeron en el mercado antes del 26 de mayo de 2021 de acuerdo con la AIMDD o MDD o de acuerdo con las normas aplicables antes de la entrada en vigor de las Directivas.
Productos MDR son aquellos que se introducen en el mercado de conformidad con MDR no siendo productos «legacy».
NOTA: Recordar que el concepto de «introducción en el mercado» es un concepto jurídico de los reglamentos y se refiere a cada producto individual, no a un tipo de producto y es realizada por el fabricante o por el importador si el fabricante no es europeo. Los distribuidores comercializan el producto. 
Título «Experto Productos Sanitarios» 2021-22 por la @UniBarcelona inicio 20 oct’2021
Mejora tu conocimiento y reconocimiento de tu experiencia, en esta formación donde participan reconocidos expertos del sector. Este año también en modalidad online. Puedes ver el programa, inscripción y cuadro docente
Como cada año colaboramos en:
• Electromedicina, IVD e implantables activos. — profesores: Claire Murphy y Xavier Canals
Exito de la formacion “Como afrontar la regulacion de tu producto sanitario?” by @CIMTI_cat con la colaboración de @tecno_med
Con más de 240 asistentes realizamos esta formación cuyo objetivo era la divulgación de los nuevos reglamentos de productos sanitarios europeos necesarios para obtener el marcado CE y poder comercializar estos productos. Las presentaciones están grabadas si te interesa puedes acceder a estas, enviando un mail a xfontanals@tecno-med.es
El Centro para la Integración de la Medicina y las Tecnologías Innovadoras (CIMTI) es un centro que tiene como misión impulsar proyectos innovadores en el ámbito de la salud y social para que las innovaciones de alto impacto lleguen al sistema y la ciudadanía se pueda beneficiar. El CIMTI está al servicio de los emprendedores del sector sociosanitario y del sistema catalán de salud y social. Está impulsado por la Fundación Leitat con el apoyo del Departament de Salut de la Generalitat de Catalunya, y la Agència de Qualitat i Avaluació Sanitàries (AQuAS). Además, dispone de una alianza estratégica con el CIMIT de Boston, el Healthcare Living Lab Catalonia (HCLLC) y el evento Healthio de Fira de Barcelona.
MDCG: nueva MDCG 2021-24 «Guia de clasificación de productos sanitarios»
EUDAMED publica la guía del modulo de productos

Los módulos de productos y el de certificados de EUDAMED entran en funcionamiento https://ec.europa.eu/tools/eudamed/#/screen/home y nos va a permitir la carga de los distintos datos de estos para que los Organismos Notificados establezcan que están amparados por sus certificados. Se incluye además el buscador de nomenclatura EMDN. read more…
EUDAMED abiertos modulos de productos y de certificados que se unen al de agentes economicos

Los módulos de productos y el de certificados de EUDAMED entran en funcionamiento https://ec.europa.eu/tools/eudamed/#/screen/home y nos va a permitir la carga de los distintos datos de estos para que los Organismos Notificados establezcan que están amparados por sus certificados. Se incluye además el buscador de nomenclatura EMDN.
La puesta en marcha oficial de EUDAMED es el 26 de mayo de 2022, por lo que según la MDCG 2019-4 tenemos hasta 26 de mayo de 2024 para el registro de productos MDR. A partir de esta fecha el registro formará parte de la obtención del marcado CE para el producto. Atención que desde 26 de mayo de 2021 debemos asignar estos códigos UDI a nuestros productos. read more…
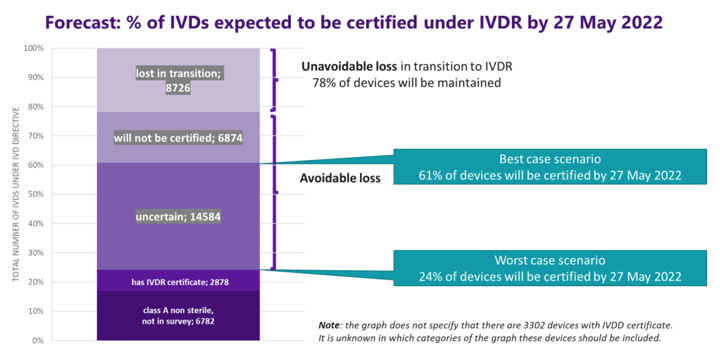
@MedtechEurope ( @FENIN_es ) publica el informe MedTech Survey Report de analisis de disponibilidad de productos IVD en mayo 2022
En este informe se destaca la dificultad de llegar a las fechas de aplicación del IVDR 25 de mayo de 2022 y en base a la encuesta en el sector hace esta previsión:
Los únicos productos sanitarios para diagnóstico in vitro que no parecen estar en riesgo son los de clase A y los que ya tenían certificado de marcado CE con la directiva, para los demás, concluye MedTech que sin una acción inmediata por parte de la Comisión Europea, entre el 22% y el 76% de los IVD se perderán para los servicios de salud de la UE y mundiales; siendo las pequeñas y medianas empresas las más afectadas.