PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN
Formación «2107 -EVALUACIÓN CLÍNICA E INVESTIGACIÓN CLÍNICA SEGÚN MDR y EN ISO 14155:2020» – 04 NOV 2021 9h-14h
![]()
La evaluación clínica es obligatoria para todos los productos sanitarios. La investigación clínica será prácticamente inevitable para los casos de productos implantables o de Clase III. En esta formación, revisaremos las últimas directrices MDCG y normativa aplicables, incluyendo la EN ISO 14155:2020 Good Clinical Practice, y su aplicación para cumplir las exigencias del Reglamento MDR.![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
La MDCG (Grupo de Coordinación de Productos Sanitarios) publica una nueva versión de la guía 2019-6 «FAQ Requisitos relativos a los Organismos Notificados»
Dia Mundial de la Ingenieria Clinica #GlobalCEDay2019 21’Oct 2019 @SEEIC_Spain @SEIB_twit @SEISeSalud @AEIHorg @CEDifmbe @AAMI_connect @WHO
El Día Mundial de la Ingenieria Clínica (CE – Clinical Engineering) es una celebración mundial que reconoce la importante contribución de los ingenieros clínicos a la mejora de la salud y el bienestar de la población mundial. Se celebra anualmente el 21 de octubre. La SEEIC participa activamente en este evento.
Durante este día, los eventos globales del sector tienen como objetivo educar y sensibilizar sobre la experiencia y los beneficios que aporta la Ingenieria Clínica a los sistemas de prestación de asistencia sanitaria al abordar los desafíos asociados al desarrollo y la utilización de una tecnología segura, eficaz, accesible y asequible.
En coordinación con las organizaciones internacionales tales como IFMBE, y la Organización Mundial de la Salud (OMS), así como con las asociaciones regionales, ejemplos específicos de las contribuciones de la CE están siendo recogidos y publicados en sus sitios web.
En ese día, durante 24 horas, el sitio web presenta entrevistas con miembros de la comunidad CE, poniendo de relieve la función de las asociaciones de todo el mundo tales como ACCE, sala de chat en diferentes idiomas, y streaming de videos que muestran off diversos papeles y funciones de la CE. Para obtener más información acceda a http://global.icehtmc.com.
Congreso ICEHTMC by AIIC Asociación Italiana de Ingenieria Clínica en la que participa la @SEEIC_spain
Premio Honorífico de la Fundación Tecnología y Salud 2019 a Mª Carmen Abad de @AEMPSgob con @FENIN_es
Entrega del Premio Honorífico de la Fundación TyS a Mª Carmen Abad Luna Jefa del Departamento de Productos Sanitarios durante 30 años y la mayor experta española en tecnología sanitaria. Enhorabuena !!! read more…
Jornada «Preparativos BREXIT» by @FENIN_es
Con la participación de Maria Alaez y Mª Carmen Ruiz-Villar. Inscribase enviando sus datos a Marisol González, Coordinadora de Formación y Normalización de Fenin: m.gonzalez@fenin.es
Exito jornada «Vigilancia de Productos Sanitarios MDR» Madrid 26 Sept 2019 Madrid by @AEFI_es con la participación de Claire Murphy @tecno_med
El curso se realizó con éxito tanto en Madrid como en Barcelona y se abordaron de forma global y práctica los aspectos principales relacionados con la gestión de la vigilancia de los productos sanitarios según el nuevo reglamento.
Como ya sabéis los requisitos de vigilancia y postcomercialización también se aplican a los productos legacy (que mantienen marcado CE según las directivas con intervención de Organismo Notificado).

08.45 – 09.00h Recepción
09.00 – 09.15h Presentación e introducción a los objetivos de la jornada Carmen Aguilera. Vocal de Productos Sanitarios. AEFI – Sección Centro
09.15 – 10:30h Sistema de Vigilancia de PS Mercedes Reza, Vigilancia de PS, AEMPS
10.30 – 11:00h Responsable de Vigilancia de PS: Funciones Mercedes Reza, Vigilancia de PS, AEMPS
11:00 -11:30h Café
11:30 – 12:30h Notificación Incidentes PS, Alertas y Acciones Correctivas (FSCA, FSN) (Incluirá Ejemplos Prácticos) Ignacio Barea, BPharm. Regulatory Affairs & Market Access. 3M HCBG Iberia
12:30 – 13:30h Informes de Seguridad y de Tendencias Claire Murphy, Socio Consultor Tecno-med Ingenieros
13:30 – 15:00h Almuerzo de trabajo
15.00 – 15:30h Tarjetas Implantación (Incluirá Ejemplos Prácticos) Claire Murphy, Socio Consultor Tecno-med Ingenieros
15:30 – 16:45h Datos de Vigilancia en Dossier Producto (Informe Evaluación Clínica y Seguimiento Clínico Post-comercialización)
16:45– 17:15h Sesión de preguntas y respuestas
17:15h Clausura del curso.
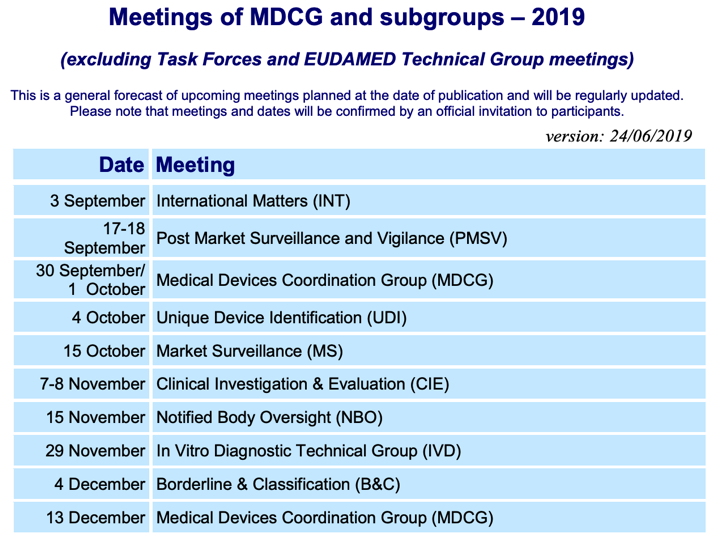
Calendario Reuniones de Trabajo de la MDCG (Grupo de Coordinación de Productos Sanitarios)
Jornada «Vigilancia de Productos Sanitarios MDR» Madrid 26 Sept 2019 Madrid by @AEFI_es con la participación de Claire Murphy @tecno_med

El curso que es una nueva edición del que se realizó con éxito en Barcelona y pretende abordar de forma global y práctica los aspectos principales relacionados con la gestión de la vigilancia de los productos sanitarios según el nuevo reglamento. read more…
Boletin trimestral @AEMPSgob de Productos Sanitarios
Congreso EMC Europe 2-6 Sept 2019 Barcelona by @GCEM_upc
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
En breve será publicada la nueva edición de la norma EN ISO 14971:2019/A11:2021

Boletin @AEMPSgob 3T 2021 de productos sanitarios y cosméticos
La AEMPS publica el boletin del TERCER TRIMESTRE 2021. Interesantes las noticias de las Correcciones de errores de MDR e IVDR y la consulta publica del RD de ps para IVD, las guías de MDCG, las listas de normas armonizadas, las notas informativas de seguridad y de control de mercado, Registro RENACER de productos de asistencia circulatoria y respiratoria, …
También se hace eco de la ampliación de plazo de la adecuación del etiquetado e IFU hasta 30 septiembre 2022 (Nota informativa PS 29/2021). Inscríbete a este boletin para seguir las actividades y novedades que nos presentan las autoridades sanitarias españolas: https://www.aemps.gob.es/listas-de-correo-electronico/
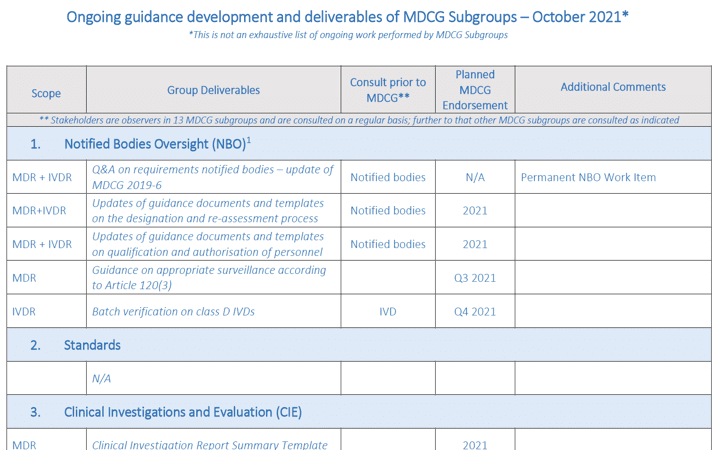
MDCG (Grupo de Coordinación de Productos Sanitarios) publica la lista de guías en curso
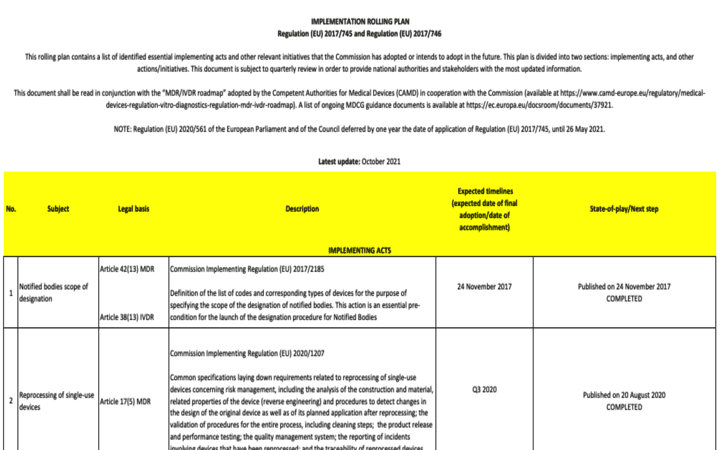
La Comisión Europea publica la actualización del Rolling-plan (Oct-2021)
Este plan de implementación contiene una lista de los actos de ejecución esenciales identificados y otras iniciativas relevantes que la Comisión ha adoptado o tiene la intención de adoptar en el futuro. Este plan se divide en dos secciones: actos de implementación y otras acciones / iniciativas. Este documento está sujeto a revisión periódica para proporcionar a las autoridades nacionales y a las partes interesadas la información más actualizada.
Seguiremos informando …
La MDCG publica la actualización del Joint Implementation Plan (Oct-2021) para IVD
MDCG: nueva MDCG 2021-26 «Preguntas y respuestas sobre las actividades de re-embalado y re-etiquetado bajo el articulo 16 de MDR e IVDRGuia de clasificación de productos sanitarios»
Ya tuvieron una primera entrada en la MDCG 2021-23 de agosto en la que se aclaraba que el certificado de ISO 13485 deben incluir en su alcance las actividades del articulo 16(4) que están incluidas, y nos anunciaba la futura publicación de esta de preguntas y respuestas.
Los importadores y distribuidores que realicen estas actividades de art.16(2) son denominados «parallel traders» y en estas FAQs nos explican por ejemplo:
– que a los hospitales que pueden re-envasar el producto que les llega en cajas grandes en otras menores para su uso en sus instalaciones no son considerados aplicables los requisitos de art.16.
– que no se aplica los productos «legacy», salvo si así lo desea hacer el agente económico
– que se puede re-envasar cambiando cantidad de productos incluidos (e.g. caja de 100 a granel, lo re-embalo en nuevas cajas de 20) justificando su necesidad
– que si nos viene un contenedor de transporte con muchos productos el separarlos no esta considerado como aplicable art. 16 (e.g. caja de 100 productos en cajas individuales, lo separo en las 100 cajas individuales)
– que la información indicada en art.16 debe enviarse al fabricante puede incluir ademas información para PMS de estos productos y lo mismo a las AASS
– que debe comunicarse la primera vez que se hace re-etiquetado o re-envasado pero que no se precisa en las siguientes, salvo en los casos que nos lista de ejemplo
– que el certificado de ISO 13485 especifico será necesario también para productos de autocertificación (Clase I o A)
– que el numero de LOT / SN del fabricante original no puede cambiarse aunque puede añadirse información como p.ej. un sublote
– que al traducir una IFU no hace falta incluir la IFU original
– que debe incluirse el UDI del fabricante y mantener trazabilidad de los UDIs de productos recibidos y suministrados.

La Comision Europea @EU_Health publica una propuesta de despliegue progresivo (=aplazamiento) del IVDR – también periodo de gracias distribuidores

Viendo la debacle que se nos avecina para el IVDR la Comisión Europea ha tomado las riendas y lanza esta propuesta de aplicación progresiva que intentamos resumiros aqui siguiendo el texto de la propuesta: (marcamos en rojo como quedan los periodos de gracia para los distribuidores)
1. fecha de aplicación general IVDR sin cambios: 26 mayo 2022 pero sólo aplica a clase A (sin intervención de ON) y nuevos productos introducidos en el mercado.
La comercialización o puesta en servicio de estos productos por distribuidores introducidos en el marcado antes de 26 de mayo 2022 podrá realizarse hasta 26 mayo 2025.
2. productos legacy IVD certificados (ps ivd con certificado IVDD de ON, de anexo II y autodiagnostico) se extiende hasta 27 mayo 2025 (antes 2024).
La comercialización o puesta en servicio de estos productos por distribuidores podrá realizarse hasta 26 mayo 2025.
3. productos legacy IVD (ps ivd que pasan a precisar ON con IVDR) se extiende el plazo de 26 mayo 2022 a los siguientes:
– clase D 27 mayo 2025
– clase C 27 mayo 2026
– clase B y A estériles 27 mayo 2027
en ambos casos legacy (2 y 3) sin cambios significativos en el producto, cumpliendo PMS y PMV de IVDR y cumpliendo los requisitos de registro.
La comercialización o puesta en servicio de estos productos por distribuidores se extiende el plazo a los siguientes:
– clase D 26 mayo 2026
– clase C 26 mayo 2027
– clase B y A estériles 26 mayo 2028.
4. productos in-house o LDT pasan a extender los plazos hasta 27 mayo 2024 para los requisitos como el sistema de calidad ISO 15189 y hasta 26 mayo 2028 para la necesidad de justificar que no hay un producto equivalente en el mercado.

Esta propuesta es el resultado de la presión que han hecho las partes interesadas y así el Parlamento Europeo, en carta de 11 de mayo de 2021, pidió a la Comisión que presentara una propuesta legislativa para garantizar una transición fluida al nuevo marco regulador.
PLAZOS
Esta propuesta pasa ahora al Consejo y al Parlamento para su trámite legislativo, y ya nos preguntan muchos clientes que cuando se espera la publicación. El plazo «normal» es de un año aproximadamente, pero si pensamos que será tramitado de urgencia como el el caso de MDR este tardó menos de 3 meses, es decir en enero lo tendremos.
Ver nota de prensa y FAQ. Ya lo comentamos en nuestra ultima formación que esta era la posibilidad mas esperable por analogía a la MDR, en vez de ser en un sólo periodo nos han sorprendido con un escalado, que pensamos debería ir al revés … primero los de menos riesgo y después los de mas riesgo ..
Os iremos informando … (ver en la web de la Comisión Europea)
La Comision Europea @EU_Health publica una propuesta de despliegue progresivo (=aplazamiento) del IVDR

Viendo la debacle que se nos avecina para el IVDR la Comisión Europea ha tomado las riendas y lanza esta propuesta de aplicación progresiva que intentamos resumiros aqui siguiendo el texto de la propuesta:
1. fecha de aplicación general IVDR sin cambios: 26 mayo 2022 pero sólo aplica a clase A (sin intervención de ON) y nuevos productos introducidos en el mercado.
2. productos legacy IVD certificados (ps ivd con certificado IVDD de ON, de anexo II y autodiagnostico) se extiende hasta 27 mayo 2025 (antes 27 mayo 2024).
3. productos legacy IVD (ps ivd que pasan a precisar ON con IVDR) se extiende el plazo de 26 mayo 2022 a los siguientes:
– clase D 27 mayo 2025
– clase C 27 mayo 2026
– clase B y A estériles 27 mayo 2027
en ambos casos legacy (2 y 3) sin cambios significativos en el producto, cumpliendo PMS y PMV de IVDR y cumpliendo los requisitos de registro.
4. productos in-house o LDT pasan a extender los plazos hasta 27 mayo 2024 para los requisitos como el sistema de calidad ISO 15189 y hasta 26 mayo 2028 para la necesidad de justificar que no hay un producto equivalente en el mercado.

Esta propuesta es el resultado de la presión que han hecho las partes interesadas y así el Parlamento Europeo, en carta de 11 de mayo de 2021, pidió a la Comisión que presentara una propuesta legislativa para garantizar una transición fluida al nuevo marco regulador.
PLAZOS
Esta propuesta pasa ahora al Consejo y al Parlamento para su trámite legislativo, y ya nos preguntan muchos clientes que cuando se espera la publicación. El plazo «normal» es de un año aproximadamente, pero si pensamos que será tramitado de urgencia como el el caso de MDR este tardó menos de 3 meses, es decir en enero lo tendremos.
Ver nota de prensa y FAQ.
Ya lo comentamos en nuestra ultima formación que esta era la posibilidad mas esperable por analogía a la MDR, en vez de ser en un sólo periodo nos han sorprendido con un escalado, que pensamos debería ir al revés … primero los de menos riesgo y después los de mas riesgo ..
Atención pues que como actores debemos establecer planes para los productos ivd (incluyendo se) y sus accesorios.
Os iremos informando …