PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2108 -MARCADO CE DE PRODUCTOS SANITARIOS – MDR y RD» – 14 DIC 2021 9h-14h
Se ha adoptado y ha entrado en vigor el nuevo Reglamento de Productos Sanitarios MDR. Desde 26/05/2021 se aplica quedando derogada la Directiva 93/42/CEE. En esta formación revisamos todas las novedades focalizando en el impacto de estos cambios en los procedimientos actuales de marcado CE de los productos sanitarios. Así mismo, planteamos los plazos de transición establecidos para la plena aplicación de los requisitos a lo largo de los próximos años. Incluimos la revisión de los requisitos nacionales según el RD de productos sanitarios.
Nota: la teleformacion finaliza el 30 de diciembre de 2021.![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Symposium AEFI 14-15 Marzo 2019 Barcelona by @AEFI_es con la participación de @Tecno_med
Como cada año tenemos una cita en el SYMPOSIUM AEFI, este año del 25-26 de Marzo y
y con la participación de Tecno-med en TALLER 3 «Clasificación Producto Sanitario para Diagnóstico in Vitro» y TALLER 7 “Requisitos relativos a la información proporcionada con el producto según reglamentos”
![]()
Este es el programa de productos sanitarios:
25 Marzo 2020
9h30 Recogida de información
10h Conferencia inaugural
11h-11h30 Café
11h30-13h MESA 2 «Competencias nacionales aplicación MDR – Cambios en RD 1591/2009» – Sala 1
13h-14h30 MESA 5 «El nuevo Reglamento de PSDIV y sus distribuidores: piezas clave en la obtención de datos clínicos» – Sala 1
14h30-16h almuerzo
16h-17h30 TALLER 3 «Clasificando Productos Sanitarios para Diagnóstico in Vitro» – Sala 3 (Tecno-med Ingenieros)
17h30-19h Asamblea General AEFI
21h Cena Symposium
26 Marzo 2020
9h-10h30 MESA 12 «Eudamed + UDI: El nuevo portal europeo de PS» – Sala 2
10h30-11h Café
11h-12h30
12h30-13h30 Conferencia de clausura
13h30-14h30 TALLER 5 «Nuevo reglamento de productos sanitarios: Impacto en el PMS» – Sala 1
13h30-14h30 TALLER 7 «Requisitos relativos a la información proporcionada con el producto según reglamentos» – Sala 3 (Tecno-med Ingenieros)
14h30-15h30 almuerzo
15h30-17h TALLER 8 Sistema de Vigilancia de PS: ¿rellenamos el nuevo formulario MIR (Manufacturer Incident Report)? – Sala 2
17h Clausura del Symposium
No te pierdas este evento, esperamos poder saludarte allí en persona.
Como cada año nosotros jugamos al 13485 en la lotería de Navidad !!
Iniciadas las pruebas funcionales de la versióun 4 del modulo de pruebas de la base de datos EUDAMED en 12 diciembre 2019
La Unidad R3 – Enterprise Information Systems anuncia la liberación del modulo de DTX version 4 operativo y cierra su fase de prueba por los actores invitados el próximo 31 de enero de 2020. Entre los actores invitados vemos correos de fabricantes (JnJ, Stryker, Medtronic, Alcon, Coopervision, Siemens, ..), Autoridades Sanitarias (AEMPS, MPA, ANSM, …), Asociaciones sectoriales (COCIR, Medtech, Euromcontact, EAAR …) y Organismos Notificados (TUV-SUD, BSI, AEMPS, …) read more…
Reunion Consejo de Empleo, Política Social, Sanidad y Consumidores 9 de Diciembre de 2019 14h15 – medical devices and in vitro diagnostic medical devices State of play in the implementation of MDR and IVDR
Esta es la intervención de Stella Kyriakides la nueva comisaría europea. Nos dice que antes de fin de año tendremos 3 nuevos Organismos Notificados y 20 en el primer trimestre de 2020. También afirmó que estamos totalmente comprometidos con el cumplimiento del objetivo de mayo de 2020 y que más de 700 expertos han solicitado participar en los nuevos paneles de expertos.
Esta es la intervención de la ministra española Mª Luisa Carcedo:
Aplicación IVDR – aprobado el segundo Corrigendum de IVDR que no modifica los periodos de gracia y de liquidación
Aunque la noticia la ha dado el corrigendum 2 del MDR también tenemos uno para el IVDR
En la sesión del 3 de Diciembre del comité ENVI del Parlamento Europeo se ha aprobado el borrador presentado de un segundo Corrigendum de ambos reglamentos MDR e IVDR.
El Corrigendum 2 del IVDR, para los productos sanitarios IVD no modifica el periodo de gracia, por el que los productos IVD con certificado de ON vigente pueden seguir fabricándose hasta 27 mayo 2024, no lo modifica por lo que no se aplica a los de autocertificación que pasan a tener intervención de ON (como seria por analogía a MDR).
EXITO «Jornada sobre el nuevo reglamento de productos sanitarios» by @IISLaFe @itemas con la participación de @tecno_med
ULTIMAS PLAZAS «Jornada sobre el nuevo reglamento de productos sanitarios» by @IISLaFe @itemas con la participación de @tecno_med
Recordamos que la Jornada será retransmitida por Streaming. Se proporcionará el link de acceso a todas aquellas personas que estén inscritas. read more…
FALTAN 2 AÑOS y MEDIO para 26 mayo 2022 fin periodo transitorio del Reglamento (EU) 2017/746 de Productos Sanitarios IVD
Jornada @UB_IL3 «Aplicación de la impresión 3D en la fabricación de productos sanitarios y de medicamentos» con la participación de @tecno_med
La Comisión Europea busca expertos en Productos Sanitarios
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
La Comision publica un borrador de Reglamento de ejecución relativo a EUDAMED
La Comisión ha publicado el borrador de regulación de la base de datos EUDAMED desarrollando requisitos y responsabilidades.
Seguiremos informando …
@MedTechEurope ( @FENIN_es ) publica actualización de los símbolos usados en MDR e IVDR según la ISO 15223-1
La federación de empresas europeas de Tecnología Sanitaria MedTech ( https://www.medtecheurope.org ), cuyo miembro en España es FENIN ( https://www.fenin.es ), ha publicado una actualización (version 3) de la guía donde podemos ver símbolos útiles para el etiquetado e instrucciones de uso según la nueva edición de la ISO 15223-1.Es muy útil la tabla de los símbolos con su traducción a los distintos idiomas.

El Organismo Notificado DEKRA @DekraEspana @DEKRA_Cert_USA carga el primer certificado MDR en modulo de certificados de EUDAMED
El módulo de Organismos Notificados y Certificados de EUDAMED está en funcionamiento https://ec.europa.eu/health/md_eudamed/notified-bodies-and-certificates-module_es
Aunque tal y como indica la página los ON no están obligados a cargar certificados hasta que este funcional EUDAMED (26 mayo 2022) ya tenemos el primer certificado del Organismo Notificado 0344 DEKRA para un software médico. Enhorabuena
Atención que desde 26 de mayo de 2021 debemos asignar estos códigos UDI a nuestros productos.
Aparece mucha información de este y sorpresa, al menos por lo que nos habían contado, esta el certificado en pdf emitido por el ON read more…
Nueva guía de FDA para los 510k de software medico @FDAdeviceInfo
FDA introduce el concepto «función de software del producto», cuya definición es:
Función de software del producto: función de software que cumple con la definición de producto en la sección 201 (h) de la Ley FD&C. “Software como dispositivo médico (SaMD)” y “Software en un dispositivo médico (SiMD)” son funciones de software del dispositivo.
Por ejemplo, la función de software de un dispositivo puede controlar un dispositivo de hardware o ser parte de un dispositivo de hardware (es decir, Software en un dispositivo médico, o SiMD) o ser un dispositivo sin ser parte de un dispositivo de hardware (es decir, Software como un dispositivo médico o SaMD).
Para cualquier producto dado, el término «función» es un propósito distinto del producto, que podría ser el uso previsto o un subconjunto del uso previsto del producto.

EUDAMED abre una pagina para el modulo de certificados para los Organismos Notificados

Los módulos de productos y el de certificados de EUDAMED entran en funcionamiento https://ec.europa.eu/health/md_eudamed/udi_devices_registration_en y https://ec.europa.eu/health/md_eudamed/notified-bodies-and-certificates-module_es
read more…
EUDAMED abre una pagina para el modulo de productos y de certificados

Los módulos de productos y el de certificados de EUDAMED entran en funcionamiento https://ec.europa.eu/health/md_eudamed/udi_devices_registration_en y nos va a facilitar el uso de este nuevo modulo, que como siempre usabilidad baja. Se incluye además el buscador de nomenclatura EMDN.
La puesta en marcha oficial de EUDAMED es el 26 de mayo de 2022, por lo que según la MDCG 2019-4 tenemos hasta 26 de mayo de 2024 para el registro de productos MDR. A partir de esta fecha el registro formará parte de la obtención del marcado CE para el producto. Atención que desde 26 de mayo de 2021 debemos asignar estos códigos UDI a nuestros productos. read more…

FDA @FDAcdrhindustry : el presidente Biden ha nominado a Robert Califf como Comisionado de la FDA
Publicada la guía de «Requisitos de Pruebas Clínicas para el marcado CE IVDR» by @medtecheurope – @FENIN_es

La evaluación del funcionamiento es obligatoria para todos los productos sanitarios para diagnóstico in vitro según IVDR. Esta evaluación del funcionamiento debe demostrar: la validez científica, el funcionamiento analítico y el funcionamiento clínico según art.56 y parte A anexo XIII de IVDR. En esta guía MEDTECH hace un repaso de la interpretación de distintos puntos del reglamento.
Os seguiremos informando. ven a nuestras formaciones
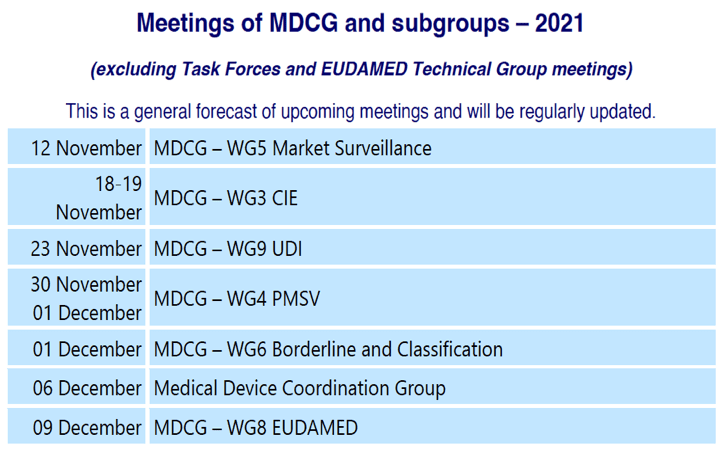
Calendario Reuniones de Trabajo de la MDCG (Grupo de Coordinación de Productos Sanitarios)
nos mantiene informados Mario Gabrielli Cossellu que es Ingegnere Elettrotecnico, Ingeniero Industrial, Abogado y Policy and Legal Officer en la Comisión Europea (y además es español) – un referente para productos sanitarios !!!
![]()