PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2202 -EN ISO 13485 Y REQUISITOS MDR-IVDR ANEXO IX» – 23 FEB 2022 9h-14h
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

Webinar «Monitorización microbiológica de instalaciones de fabricación de productos sanitarios» (Eurofins BPT Spain) @eurofins
Claudia Dei Negri nos informa de este webinar gratuito que van a realizar, gracias. A raíz de la pandemia de COVID19 muchos fabricantes del sector textil y de otras industrias están orientándose al sector sanitario, debido a la gran demanda de productos sanitarios (mascarillas y batas médicas, guantes, otros productos de uso clínico y hospitalario, etc.). read more…

Convocatoria extraordinaria H2020 para proyectos COVID-19 con #productossanitarios hasta 11 junio
FENIN nos informa de esta convocatoria donde tenemos varias acciones interesantes: read more…
Día Mundial de los Ensayos Clínicos también con #productossanitarios 20’May #DMEECC #CTD2020
desde Tecno-med queremos agradecer a los profesionales y fabricantes españoles su contribución en el avance de la tecnología sanitaria ¡GRACIAS!.
Con los nuevos reglamentos veremos incrementado el nivel de evidencia clínica exigida a productos sanitarios y nos olvidaremos de la vergüenza que hemos pasado con las mascarillas, ventiladores pulmonares, tests IVD, …

Organismos Notificados: Intertek (Suecia) NB num. 2862 nuevo ON con MDR. Enhorabuena!!!

Master en PRODUCTOS SANITARIOS Universidad Valencia 2019-2020

HTM week – Semana de la Gestión de la Tecnología Sanitaria @AAMI_connect @SEEIC_spain 17 a 23 mayo 2020
Esta semana del 17 al 23 de mayo de 2020 es la Semana de la Health Technology Management, se celebra anualmente es patrocinada por la Asociación para el Avance de la Instrumentación Médica (AAMI) – USA. En España la asociación que reúne a estos profesionales es la SEEIC Sociedad Española de Electromedicina e Ingeniería Clínica.
Estos profesionales de la salud son responsables del servicio, mantenimiento y la gestión de tecnologías de atención médica para hospitales y otros centros sanitarios, fabricantes y organizaciones de servicios de asistencia técnica en todo el mundo. Técnicos expertos ayudan a adquirir, instalar, mantener y capacitar y apoyar al personal sanitario en tecnología médica de vanguardia.

Feliz dia de S. Jordi (CAT) – S. Jorge (ARAGON)

Formación «Electromedicina, equipos analizadores de IVD e implantables activos según MDR e IVDR» en el curso «Experto Productos Sanitarios» 2020 @UniBarcelona
Este año vía webinar
nos vuelve a tocar nuestra clase … 23 abril 2020
Con la novedad del aplazamiento del Reglamento (EU) 2017/745 MDR del 26 mayo de 2020 hasta el 26 de mayo de 2021.
Con la participación de Claire Murphy y Xavier Canals de Tecno-med Ingenieros como parte del equipo de profesores.
mas información: http://www.ub.edu/tecnofarm/tecnologia/masters-i-postgraus/#1500545361571-6159738d-5f5c

Dia Internacional de las ciencias de la esterilizacion 10 Abril
Hoy es el dia internacional de las ciencias de la esterilización. Queremos dedicar hoy nuestro aplauso y mandar un abrazo a todos los profesionales que desde los sótanos de los hospitales permiten que estos sigan funcionando.
Ver el blog de nuestro colega Juan José Criado que siempre nos trae información https://elautoclave.wordpress.com/2018/04/10/10-de-abril-dia-internacional-de-las-ciencias-de-la-esterilizacion/

#COVID19 FAQ regulatorias (5) – ¿POR QUE NO FUNCIONAN algunos Kits IVD COVID19? debemos esperar al reglamento IVDR
Una noticia que ha sembrado la desconfianza de la población respecto a los productos sanitarios para diagnóstico in vitro es el rechazo de los kits que tenían ya el marcado CE por parte del gobierno español después de realizar ensayos de sensibilidad en el Instituto de Salud Carlos III, que dieron resultados de un 30% y 50% según los medios, muy inferiores a los normalmente aceptados >80%. read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

La IAF publica la MD 9:2022 una actualización de la guía de aplicación de la ISO 17021-1 a la ISO 13485
La IAF (International Accreditation Forum) ha publicado esta guía que usan los Organismos Notificados y Entidades de Certificación para establecer los criterios de evaluación y auditoria de los sistemas de gestión de la calidad. Actualizan la cualificación necesaria de los auditores y la tabla de tiempos de auditoria.
Su fecha de aplicación es 1 de febrero de 2023.
Esta es la tabla que como vemos ha actualizado los tiempos de fase 1 + fase 2 en la primera auditoria:
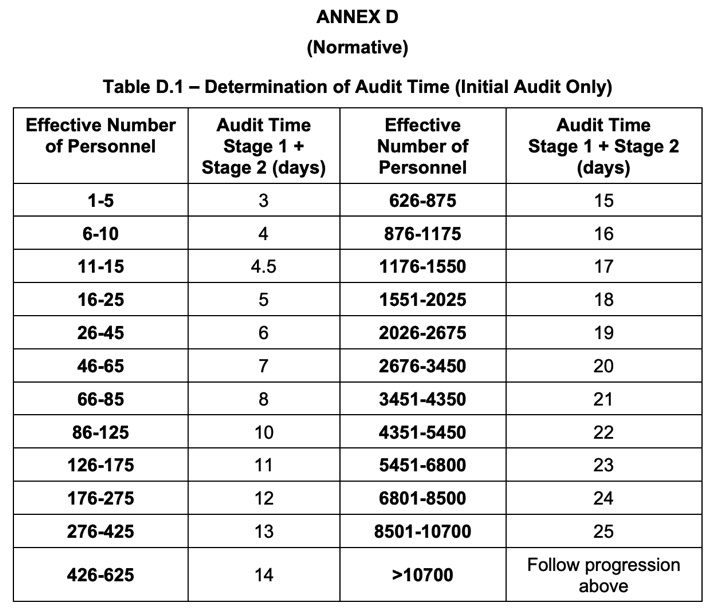
Seguiremos informando …![]()

MDCG: nueva MDCG 2022-2 Directrices sobre los principios generales de prueba (evidencia) clínica para productos sanitarios IVD
Esta MDCG describe los principios generales de la prueba (evidencia) clínica dentro del proceso continuo de evaluación del funcionamiento de los ps IVD según el reglamento IVDR. Esta guía describe el enfoque mediante el cual se puede realizar la recopilación, generación y documentación de datos que soporten al ps IVD antes de su introducción en el mercado o puesta en servicio y la PMS y PMPS posterior a la comercialización. El documento indica que se han tenido en cuenta las directrices del IMDRF (SG5/N7:2012)
Buena lectura …

ECRI publica la lista para el 2022 de los principales (TOP 10) peligros en Tecnología Sanitaria @ECRI_institute
Como cada año ECRI publica su lista de los peligros mas relevantes en el uso de Tecnologías Sanitarias.
El nº 1: Los ataques de ciberseguridad
mas información: www.ecri.org/2022hazards
Nueva web de la Comisión Europea de «Public Health» @EU_Health
Celebrada el 11 de Enero de 2022 la Reunión Grupo MDCG ANNEX XVI aprobando la versión final de las especificaciones comunes para productos sin finalidad médica de An. XVI
En esta reunión se han aprobado las especificaciones comunes en su versión final, de obligada aplicación para productos de anexo XVI, deben ahora pasar por el periodo de comentarios publico, esperando su publicación según la Comisión Europea en el segundo trimestre y en este caso entrando en aplicación en enero 2023 (a los 6 meses y 20 días de su publicación en el DOUE). ![]()
Seguiremos informando
MDCG: nueva MDCG 2022-1 Aviso a los fabricantes de terceros países de productos sanitarios de diagnóstico in vitro del SARS-CoV-2
Esta MDCG es un aviso para navegantes de la Comisión Europea dirigido a los fabricantes de kits covid para que entiendan que la pandemia no es excusa para saltarse la legislación europea.
Recuerda las obligaciones:
1. contar con un Representante Autorizado en Europa que debe notificarlo a la Autoridad Sanitaria del país europeo en el que este su sede social.
2. obtener el certificado CE si el producto es de autodiagnostico (uso por el propio paciente)
3. traducción de las etiquetas e instrucciones de uso al idioma del país donde se comercialice
4. cumplir con las especificaciones de la MDCG 2021-21 (espolier de las Especificaciones Comunes de IVDR)
5. cumplir con los periodos de gracia
Atención a la modificación del IVDR que establece que la introducción en el mercado (=fabricación e importación) de los productos legacy IVD (ps ivd con certificado IVDD de ON autodiagnostico) se extiende hasta 27 mayo 2025 y la comercialización o puesta en servicio (=distribución) de estos productos por distribuidores podrá realizarse hasta 26 mayo 2025. 
Newsletter @EU_Health «MEDICAL DEVICES NEWS» Enero 2022

Publicada nueva lista de normas armonizadas con IVDR – Decision de Ejecucion (UE) 2022/15 incluyendo edicion 2021 de EN ISO 13485 y EN ISO 15223-1
Como es lógico llega la segunda remesa para IVDR después de la primera lista en la Decisión de Ejecución 2021/1195 en el DOUE en 19 julio 2021, se publica esta segunda lista, añadiendo mas normas, como destacadas las normas EN ISO 13485 y EN ISO 15223-1. Sólo un comentario, cuando hay una modificación a la norma la manera correcta de referenciarla es añadiendo esta con un signo «+», por ejemplo la referencia a la norma de calidad es: EN ISO 13485:2016+/A11:2021 (UNE-EN ISO 13485:2018+ ….) , añadimos entre paréntesis la norma UNE «física» que tenemos en nuestro archivo; así damos la facilidad al revisor / auditor de comprobar que mantenemos cumplimiento con lo publicado por la Comision en el DOUE sin tener que cruzar las fechas y modificaciones de las versiones nacionales. read more…






