PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

próxima Formación «C2203– IMPORTADORES Y DISTRIBUIDORES DE PRODUCTOS SANITARIOS SEGUN MDR/IVDR» – 29 MAR 2022 9h-14h by @tecno_med
Los reglamentos de PS refuerzan mucho los requisitos a los agentes económicos involucrados en el suministro, instalación, formación y mantenimiento de PS. En esta formación, revisaremos las nuevas obligaciones de los importadores y distribuidores de productos sanitarios así como el impacto de los requisitos del MDR en toda la cadena de suministro. Ven a esta formación eminentemente practica.
![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

Prepárate !!! … 26 mayo 2021 fecha de aplicación del Reglamento (EU) 2017/745 de Productos Sanitarios

Congreso @AECOC_es Sector Salud ONLINE 7-8 Oct 2020 incluye sesión UDI productos sanitarios #AECOCSalud – no te lo pierdas!! participa @tecno_med

Nuevas fechas: Symposium AEFI 10-11 Mayo 2021 Madrid by @AEFI_es
Boletin @AEMPSgob de Productos Sanitarios – jun 2020
Esta vez con periodicidad semestral debido al COVID, la AEMPS cuenta la punta del iceberg del trabajo sujeto a gran presión del Departamento de Productos Sanitarios y el Organismo Notificado durante el pico de la pandemia. También recogen la lista de publicaciones de la Comision Europea relativas a los productos sanitarios.![]()

Organismos Notificados: GMED (Francia) NB num. 0459 nuevo ON (ya 15) con MDR. Enhorabuena!!!

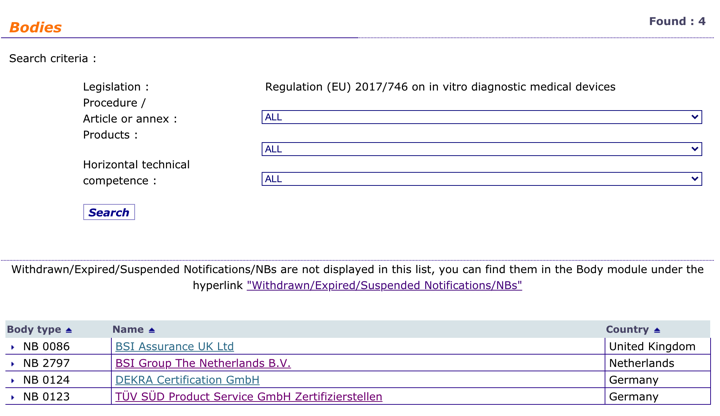
Organismos Notificados: TÜV SÜD ( @TUVSUD ) NB num. 0123 nuevo ON con IVDR. Enhorabuena!!!
Nueva designación del Organismo Notificado alemán TUV SUD Product Service para IVDR
Enhorabuena !!
Este es su lista de códigos en el alcance de su notificación (sin restricciones)

Exito Jornada ‘Smart Health: afrontando los desafíos de la salud del siglo XXI’ por @NanomedSpain , Plataforma Innovación TS ( @FENIN_es ) – con @CArmenR_V ( @AEMPSgob )
Nanomed Spain y la Plataforma Española de Innovación en Tecnología Sanitaria – FENIN organizaron esta jornada con la participación de Carmen Ruiz-Villar Jefa del Departamento de Productos Sanitarios de la AEMPS quien comentó la experiencia COVID-19 con los equipos respiradores. read more…

Organismos Notificados: bajas como ON para MDD …
Mientras aun estamos preocupados por la lentitud con la que se designan los Organismos Notificados con los reglamentos, se van produciendo bajas en los actuales con las directivas antes de su perdida de notificación obligada por el fin de periodo de gracia de 26 de mayo de 2024.
Así los Organismos Notificados NB0481 ECM Alemania y NB2282 DQS Polonia causan baja en la lista de Organismos Notificados. Otros dos desaparecen el NB0434 DNVGL al pasar a NB2460 DNVGL-Presafe y el de Luxemburgo al haber ya cesado su actividad. read more…

Symposium AEFI 16-17 Nov 2020 Madrid by @AEFI_es con la participación de @Tecno_med
Como cada año tenemos una cita en el SYMPOSIUM AEFI, este año del 16 al 17 de Noviembre (coincidiendo con MEDICA … )

Presentación del informe «Índice Fenin de Madurez Digital en Salud» de @FENIN_es y @Cotec_Innova
Este informe que según se indica se ha llevado a cabo mediante 17 entrevistas presenciales —con una duración de entre 2 y 4 horas— con los responsables de las Direcciones de los Sistemas de Información de los Servicios de Salud de las distintas comunidades autónomas read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Publicada la nueva edición de la norma ISO IEC 27002:2022 «Seguridad de la información, ciberseguridad y protección de la privacidad — Controles de seguridad de la información»
La @AEMPS_gob adjudica el contrato de «Servicio de apoyo técnico en la evaluación de la conformidad de los productos sanitarios para el marcado CE y de certificación de sistemas de calidad de productos sanitarios» a la fundación @F2I2
Enhorabuena a la Fundación para el Fomento de la Innovación Industrial a quien ha sido adjudicado este servicio para los próximos 2 años. Podeis ver el detalle de esta


Francia lanza un proyecto de inversión para industria de productos sanitarios INNOVATION SANTE 2030 que incluye ayudas a la obtención del marcado CE … a ver si cunde el ejemplo @sanidadgob @Cienciagob @SEtelecoGob
Este plan que esta incluido dentro del FRANCE 2030 pretende reindustrializar nuestro país vecino y queremos destacar la apuesta en nuestro sector de tecnologías y productos sanitarios. Estas son sus lineas estratégicas:
Eje 1: Abordar las principales prioridades tecnológicas y/o de salud pública – 170M€
Convocatorias de proyectos para desarrollar los robots quirúrgicos, implantes y prótesis y soluciones digitales para la salud mental
Eje 2: Facilitar la demostración del valor de los dispositivos médicos de uso colectivo – 60M€
Convocatoria de proyectos «demostración de la eficacia clínica de los productos sanitarios para uso colectivo» con el fin de permitir la demostración de los beneficios clínicos y/o médico-económicos de los dispositivos médicos dentro del sistema de salud francés.
Eje 3: Apoyo a proyectos de industrialización de empresas de dispositivos médicos – 140M€
Convocatoria de proyectos apoyar proyectos de industrialización de productos sanitarios e innovadores o estratégicos en el territorio nacional y proyectos empresariales en los sectores de bioterapia y bioproducción, así como en enfermedades infecciosas emergentes.
Eje 4: Apoyo a las empresas de productos sanitarios en sus trámites de acceso al mercado – 30M€
Se pondrán en marcha acciones específicas para facilitar y acelerar el acceso al mercado de los productos sanitarios y, en particular, la obtención del marcado CE de los productos, en particular mediante la creación de un mostrador de «diagnóstico reglamentario» en Bpifrance, la creación de redes de investigadores, el acceso a grandes cohortes y la financiación de la formación de perfiles reglamentarios.

QMSR: propuesta de cambio de la 21CFR820 y uso de la norma ISO 13485 por la @FDAcdrhindustry
EL CDRH de la FDA acaba de publicar esta propuesta que cambiará la denominación a QMSR Quality Management System Regulation y, si se aprueba, establecerá la aplicación de esta por los fabricantes de productos sanitarios e incluirá las desviaciones de esta norma con respecto a la 21CFR820 (será como nuestro anexo Z de la norma con respecto a los reglamentos europeos).
MDCG: nueva MDCG 2022-4 Guía sobre el control de los Organismos Notificados relativo a las disposiciones transitorias del art. 120 MDR
Esta MDCG describe los requisitos para los productos legacy que requieren que el organismo notificado que emitió el certificado bajo el MDD o el AIMDD continúe realizando el control adecuado con respecto a todos los requisitos aplicables relacionados con los productos que ha certificado Para abordar adecuadamente la aplicación de disposiciones transitorias, esta guía, redactada de acuerdo con MDCG 2021-25 sobre la aplicación de requisitos de MDR a «legacy», debe leerse junto con la MDCG 2020-3 sobre cambios significativos.
En esta guía, solo se abordan los productos cubiertos por un certificado EC válido emitido de acuerdo con el MDD o el AIMDD antes del 26 de mayo de 2021.
Buena lectura …
y anexo
Entra en vigor el Reglamento 536/2014 sobre ensayos clínicos de medicamentos y la Comisión publica un FAQ @EU_Health
La Comisión Europea publica un documento de preguntas frecuentes del reglamento 536/2014 de ensayos clínicos con medicamentos que entró en vigor el 31 de enero de 2022 y que incluye un procedimiento de autorización único en la UE y el nuevo portal de https://euclinicaltrials.eu con periodo transitorio hasta 31 de enero de 2023 para la solicitud a través de esta plataforma o aun según la directiva.
No se aplica a las investigaciones clínicas de productos sanitarios reguladas por los reglamentos MDR e IVDR y que estarán gestionados en EUDAMED, no obstante al poder intervenir estos en ensayos clínicos con medicamentos este reglamento los incluye en alguna de sus cláusulas que resumimos aqui:

La @AEMPSgob lanza la aplicación RPS de registro de responsables de la puesta en el mercado de productos sanitarios
Como anticipo al nuevo Real Decreto de productos sanitarios y el establecimiento del Registro de Comercialización la AEMPS pone en marcha esta nueva versión de RPS mejorada. Cualquier empresa establecida en España, fabricante o representante autorizado de productos sanitarios en serie de clase I; productos sanitarios a medida; productos sanitarios de diagnóstico in vitro, agrupador o esterilizador, que vaya a efectuar una comunicación al registro de responsables de la puesta en el mercado (RPS), deberá efectuarlo a través de la nueva aplicación.
Una de las mejoras que nos pedia la legislación para poder demostrar la introducción en el mercado antes de 26 de mayo de 2021 para poder aprovechar los periodos de gracias es la obtención de un documento de anotación de la comunicación que justifica que se ha realizado el trámite.
Sigue manteniendose la exención de abono de tasa. La AEMPS recomienda a las empresas que vayan recuperando y actualizando sus comunicaciones en la nueva base RPS durante este año 2022 y antes del cierre definitivo de la anterior aplicación, previsto para el año 2023.
Este es el acceso https://rps.aemps.es/

MDCG: nueva MDCG 2022-3 Verificación por los Organismos Notificados de los productos IVD clase D fabricados
Esta MDCG describe los requisitos para los Organismos Notificados en la evaluación de conformidad de los productos de IVD de mas alto riesgo los clase D. En estos además de la evaluación de la documentación técnica y el sistema de gestión de la calidad, el Organismo Notificado debe verificar los informes de los ensayos finales de cada lote y para ello un Laboratorio de Referencia (EURL) realizara un ensayo de muestras de cada lote. El ON en un plazo no mayor a 30 días desde la recepción de las muestras del lote, debe comunicar su decisión de aceptar o no dicho lote.
Buena lectura …