PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2206 – Requisitos FDA Medical Devices – Productos Sanitarios» QSUB, 510k, Reg&Listing, UDI-GUDID, QSR GMPs, … – 26 Julio 2022 9h-14h
Fecha: 26 Julio 2022, 9h a 14h en webinar en directo y 25h en teleformación.
El mercado de Estados Unidos es el mayor destino de exportación para los productos sanitarios europeos y tiene su propio sistema reglamentario distinto del europeo por lo que revisaremos cómo a partir de la documentación técnica y sistema de calidad para el Marcado CE obtenemos la autorización para la comercialización en USA presentando un 510k y el cumplimiento de la 21 CFR 820 Quality Systems Regulation.
En esta formación, conoceremos los detalles prácticos de como comercializar productos sanitarios en USA
read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Dia Internacional de las ciencias de la esterilizacion 10 Abril

Organismos Notificados: Eurofins(Finlandia) ON num. 0537 nuevo ON con MDR. Enhorabuena!!!
Nueva designación del Organismo Notificado
Eurofins Expert Services Oy
PL 47 Kivimiehentie 4, FI-02150 Espoo. Finland
Tel : +358406311311
Web : https://www.eurofins.fi/expertservices
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR … read more…
«Foro de interoperabilidad en Salud» especial programa #NewGenerationEurope by @SEISeSalud 14 y 15 abril 2021
Nueva edición del «Foro de Interoperabilidad en Salud» de la SEIS que con el lema «La interoperabilidad como herramienta tractora de la transformación digital del Sistema Nacional de Salud» se celebra en Vitoria del 14 al 15 de abril de 2021.
Este año nos han invitado a participar en la sesión:
Jueves, 15 de abril de 2021 12:30 – 14:00
“La aportación de la industria en la Interoperabilidad para los proyectos de New generation EU”
Moderador
Sr. D. Santiago García Blanco Dir.Gral Transformación Digital y Rel.usuarios. SCS
Ponentes
Sra. Dª María Ángeles Cisneros Martín Dir.Gral Infraestructuras y TI SACYL
Sra. Dª Belén Soto Bodi Presidenta de Sector E-Health Fenin
Sr. D. Xavier Canals Riera Experto en regulación de dispositivos médicos Tecno-med Ingenieros
Sr. D. Francisco Novillo Consultor de Implantación Senior Orion Health
Ir a la página de la SEIS: https://seis.es/xi-foro-interoperabilidad/
Formacion 22 abril «Electromedicina, equipos analizadores de IVD e implantables activos segun MDR e IVDR» en el curso de posgrado «Experto Productos Sanitarios» 2021 @UniBarcelona
No te pierdas esta formación si quieres ser PRCN con los nuevos reglamentos MDR e IVDR
Con la participación de Claire Murphy y Xavier Canals de Tecno-med Ingenieros como parte del equipo de profesores.
mas información: http://www.ub.edu/tecnofarm/tecnologia/masters-i-postgraus/#1500545361571-6159738d-5f5c

@MedtechEurope ( @FENIN_es ) organiza el Forum #MTF2021 20-22 abril 2021
No te pierdas el MedTech Forum, este año online, como todos los eventos del sector. Puedes ver su programa aqui
e inscribirte aqui : https://www.themedtechforum.eu/registration-2021

«Foro de interoperabilidad en Salud» by @SEISeSalud 14 y 15 abril 2021
Nueva edición del «Foro de Interoperabilidad en Salud» de la SEIS que con el lema «La interoperabilidad como herramienta tractora de la transformación digital del Sistema Nacional de Salud» se celebra en Vitoria del 14 al 15 de abril de 2021.
Este año nos han invitado a participar en la sesión:
Jueves, 15 de abril de 2021 12:30 – 14:00
“La aportación de la industria en la Interoperabilidad para los proyectos de New generation EU”
Moderador
Sr. D. Santiago García Blanco Dir.Gral Transformación Digital y Rel.usuarios. SCS
Ponentes
Sra. Dª María Ángeles Cisneros Martín Dir.Gral Infraestructuras y TI SACYL
Sra. Dª Belén Soto Bodi Presidenta de Sector E-Health Fenin
Sr. D. Xavier Canals Riera Experto en regulación de dispositivos médicos Tecno-med
Sr. D. Francisco Novillo Consultor de Implantación Senior Orion Health
Ir a la página de la SEIS: https://seis.es/xi-foro-interoperabilidad/

Jornada «IMPRESIÓN 3D EN HOSPITALES» by @COIIM participa la @SEEIC_spain 6 mayo 2021 – 17h
No os perdáis esta jornada donde tendremos la presentación de los requisitos reglamentarios de la impresión 3D en hospitales e intentaremos contar las diferencias entre las distintas opciones (a medida, in house, personalizado, adaptado, …) de los productos sanitarios en la participación de Xavier Canals Vicepresidente de la SEEIC.

Symposium AEFI 10-11 Mayo 2021 by @AEFI_es con la participación de @Tecno_med
Como cada año tenemos una cita en el SYMPOSIUM AEFI, este año del 10 al 11 de Mayo de 2021, con la participación de Tecno-med en
TALLER 3 «Clasificando Productos Sanitarios para Diagnóstico in Vitro» – 10 mayo 13h45 a 15h15 y
TALLER 9 “Reglamentos MDR/IVDR: Novedades en la información proporcionada con el producto» 11 mayo 15h a 16h
Ponentes: Xavier Canals Riera. Director Tecno-med Ingenieros y Claire Murphy. Socio Consultor Tecno-med Ingenieros ![]()
No te pierdas este evento, esperamos poder saludarte allí.
@MedTechEurope ( @FENIN_es ) publica un video de introducción a Compliance para distribuidores
La federación de empresas europeas de Tecnología Sanitaria MedTech ( https://www.medtecheurope.org ), cuyo miembro en España es FENIN ( https://www.fenin.es ), ha publicado este video de introducción a compliance.
Que el leer no nos haga perder el escribir … (el COVID parece que lo acapara todo … )
Dia internacional de la mujer 8 Mar 2021 – Symposium La mujer en la calidad by @ASQ
La ASQ asociación de la calidad celebra este dia con sesiones monográficas sobre el tema. Se puede acceder a las grabaciones de los actos y sesiones: https://videos.asq.org/product-category/channel/international-womens-day-celebration
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

Newsletter @EU_Health «MEDICAL DEVICES NEWS» Junio 2022

Guía uso del símbolo UKCA y la UK Declaración de Conformidad publicada por el gobierno de UK
Publicada una guía del uso del símbolo UKCA que es el equivalente al símbolo CE europeo para el Reino Unido. En el tema de la DoC Declaración de Conformidad, recomiendan establecer una UK DoC separada de la UE DoC. También nos suministran el simbolo UKCA.

HTA Evaluación Tecnologia Sanitaria «The Regulation on HTA – What’s 22 jun 2022 Bruselas 10h CEST por streaming
Muy orientado a medicamentos, pero con la presencia de Rossana Tarricone de MedTech (FENIN) (avanzad a las 11:59)
https://webcast.ec.europa.eu/high-level-stakeholder-conference-on-hta-gasp
El objetivo principal del evento es presentar los planes de la Comisión para la implementación del nuevo marco legal y estimular un debate con las autoridades de los Estados miembros, los organismos de HTA, los representantes de la industria, los profesionales de la salud y los pacientes sobre las oportunidades y los desafíos de los próximos tres años, hasta la aplicación del Reglamento sobre HTA en enero de 2025.
Seguiremos informando … ![]()
Reglamentos 2022/944 y 2022/945 relativos a las tareas y tasas de los laboratorios de referencia IVDR
Estos dos reglamentos de ejecución ponen las bases para que los laboratorios de referencia para que establezcan una sistemática en sus tareas y un régimen de transparencia en sus tasas … difícil incluyen por ejemplo gastos de personal (sueldos homogéneos en EU ?)

Nueva guía de FDA para el software de análisis cuantitativo de imágenes radiológicas @FDAdeviceInfo
Esta guía de la FDA establece la necesidad de incluir en los 510k evidencias del funcionamiento de las funciones de análisis de imagen cuantitativas.
Estas funciones extraen información adicional de las imágenes médicas o de los datos de imagen médica en forma de valores numéricos, como por ejemplo las mediciones de volúmenes y dimensiones en imagenes tomográficas como RMN y TAC.

MDCG: nueva MDCG 2022-11 Documento de postura. Aviso a los fabricantes para que cumplan a tiempo los requisitos del MDR
En esta publicación la MDCG da un tirón de orejas a los fabricantes.
Estas son sus conclusiones en modo telegráfico:
– más del 90% de los certificados AIMDD/MDD actualmente válidos expirarán en 2023-2024
– más del 50% de las solicitudes presentadas (a los ON) se consideraban incompletas
– a partir del 27 de mayo de 2024, el MDR será plenamente aplicable a todos los productos sanitarios. Los fabricantes son responsables de garantizar que sus productos cumplan con el MDR a partir del final del período de transición. A partir de esa fecha, los productos sanitarios que no estén certificados conforme al MDR no tendrán acceso al mercado de la UE.
– la exención del procedimiento de evaluación de la conformidad con arreglo al artículo 59 de las MDR (concedidas por las AACC – como la AEMPS) no es una solución en caso de que la transición de la AIMDD/MDD a las MDR no se complete a tiempo debido a solicitud tardía o motivos económicos
– se espera que el fabricante haya presentado una solicitud a un organismo notificado para la certificación de conformidad con el MDR al menos un año antes de la fecha de expiración del certificado MDD/AIMDD
– es esencial que todos los fabricantes ajusten su sistema, finalicen la transición al MDR y presenten una solicitud a un organismo notificado, presentando solicitudes completas y conformes, lo antes posible y con suficiente antelación al final del período de transición para garantizar el cumplimiento del MDR a tiempo. read more…
Memoria @AEMPSgob 2021
La AEMPS, publica la memoria de 2021 en la que se hace balance de este año, 512 profesionales conforman el equipo AEMPS.
El equipo de productos sanitarios cuenta con Carmen Ruiz-Villar como Jefa del Departamento de Productos Sanitarios y con Gloria Hernandez como Responsable del Organismo Notificado 0318.

Propuesta reglamento relativo a las tasas de los laboratorios de referencia IVDR
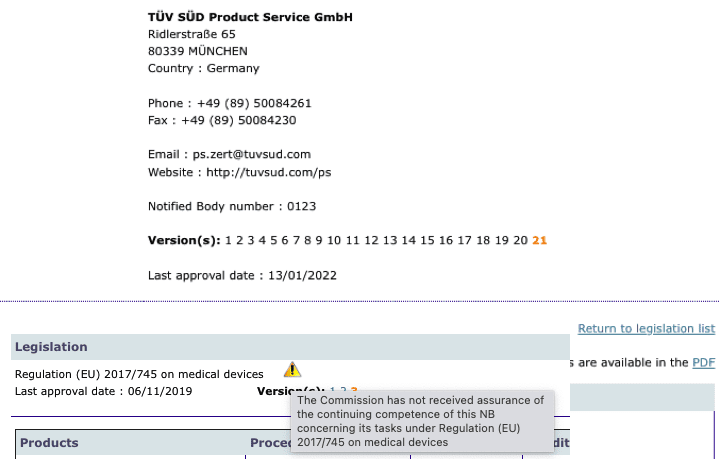
Organismos Notificados MDR: TUV SUD @tuevsued, re-notificandose … (FEFO .. el primero en notificarse –> primero en renovar … – a los 3 años)
El signo de aviso que aparece indicando que la Comisión no ha recibido la garantía de continuidad de la competencia se debe a que TUV SUD se esta renovando la notificación como Organismo Notificado. Al ser el primero le toca también el primero … ningún efecto en certificados y operación, pero como siempre momento de revisión del trabajo y operación, difíciles con pandemia y cuenta atrás 2024. read more…