PRODUCTOS SANITARIOS


.
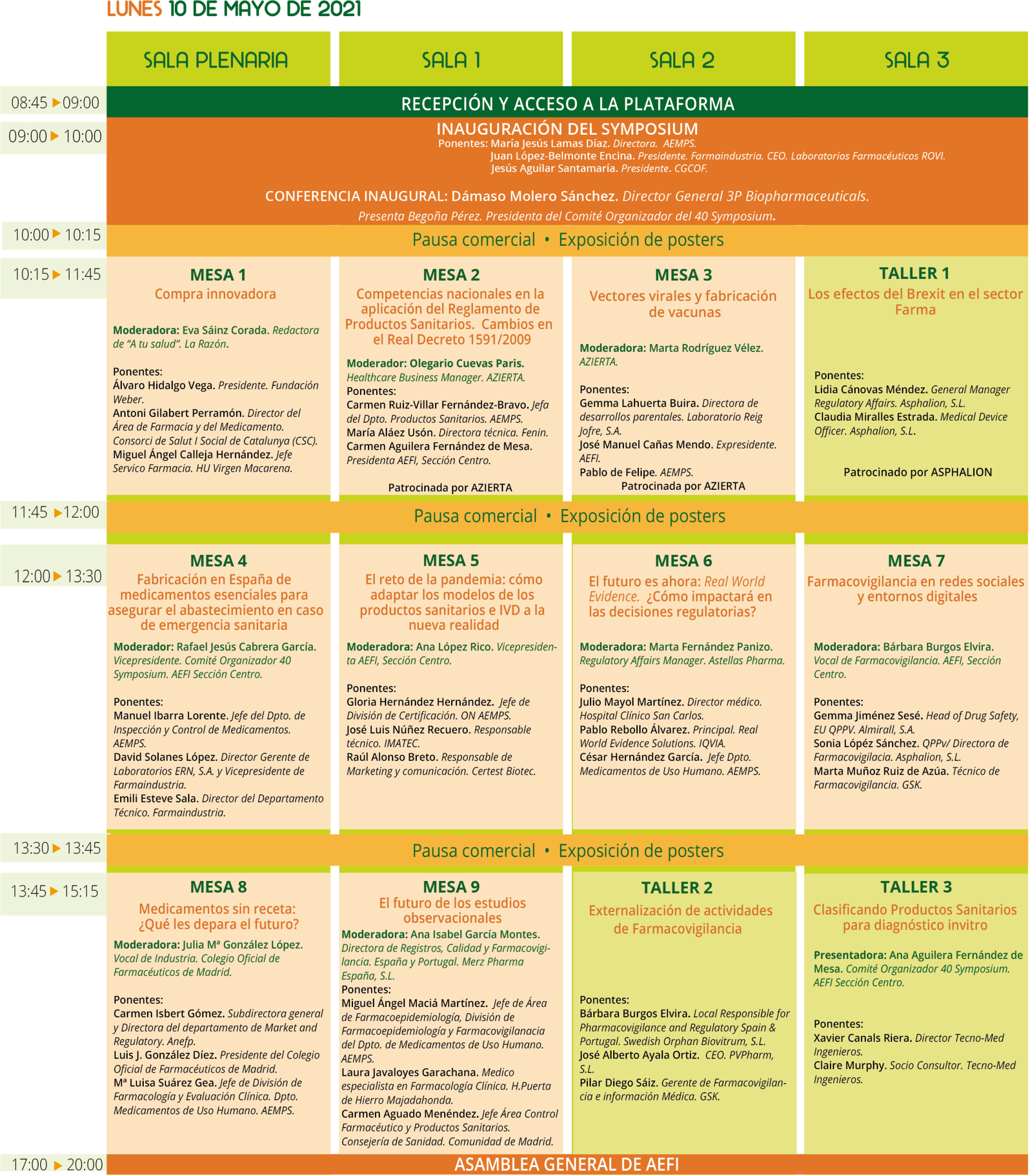
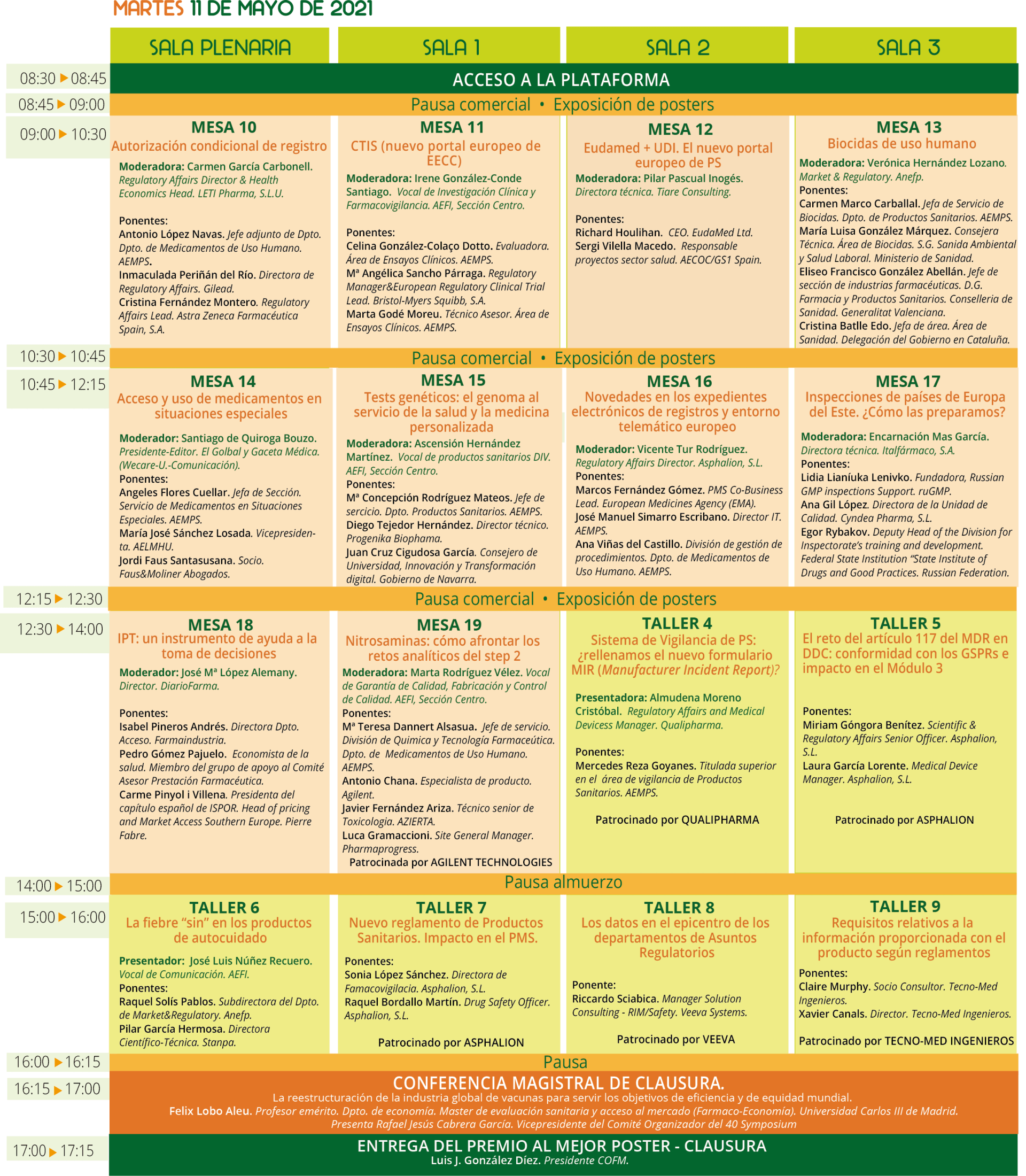
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2206T – Requisitos FDA Medical Devices – Productos Sanitarios» QSUB, 510k, Reg&Listing, UDI-GUDID, QSR GMPs, … – Teleformacion
Formación realizada en fecha: 26 Julio 2022, 9h a 14h en webinar en directo y 25h en teleformación.
El mercado de Estados Unidos es el mayor destino de exportación para los productos sanitarios europeos y tiene su propio sistema reglamentario distinto del europeo por lo que revisaremos cómo a partir de la documentación técnica y sistema de calidad para el Marcado CE obtenemos la autorización para la comercialización en USA presentando un 510k y el cumplimiento de la 21 CFR 820 Quality Systems Regulation. ![]() En esta formación, conoceremos los detalles prácticos de como comercializar productos sanitarios en USA
En esta formación, conoceremos los detalles prácticos de como comercializar productos sanitarios en USA
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

TALLER 3 «CLASIFICANDO PRODUCTOS SANITARIOS PARA DIAGNOSTICO IN VITRO» enviadnos dudas y preguntas a @Tecno_med xcanals@tecno-med.es – Symposium AEFI 11 Mayo by @AEFI_es
Como cada año tenemos una cita en el SYMPOSIUM AEFI https://www.aefi2021.com/
este año del 10 al 11 de Mayo de 2021, con la participación de Tecno-med en:
TALLER 3 “Clasificando productos sanitarios para diagnostico in vitro» 10 mayo 13h45 a 15h15
Moderadora: Ana Aguilera Fernández de Mesa. Comité Organizador
Ponentes: Claire Murphy y Xavier Canals. Tecno-med Ingenieros

Queremos revisar en este taller las nuevas reglas de clasificación de IVDR y compartir las técnicas para su correcto uso.
Puedes enviarnos tus dudas y preguntas a xcanals@tecno-med.es. Gracias
No te pierdas este evento, esperamos poder saludarte allí !!

TALLER 9 «REQUISITOS INFORMACION PRODUCTO MDR/IVDR» enviadnos dudas y preguntas a @Tecno_med xcanals@tecno-med.es – Symposium AEFI 10 Mayo by @AEFI_es
Como cada año tenemos una cita en el SYMPOSIUM AEFI https://www.aefi2021.com/
este año del 10 al 11 de Mayo de 2021, con la participación de Tecno-med en:
TALLER 9 “Requisitos relativos a la información proporcionada con el producto según reglamentos MDR/IVDR» 11 mayo 15h a 16h
Ponentes: Xavier Canals Riera. Director Tecno-med Ingenieros y Claire Murphy. Socio Consultor Tecno-med Ingenieros 
Puedes enviarnos tus dudas y preguntas a xcanals@tecno-med.es. Gracias
No te pierdas este evento, esperamos poder saludarte allí !!

Encuentro Sector Tecnología Sanitaria 19 de Mayo de 2021 «La Transformación digital de la sanidad” 12h a 13h30 by @ESADE & @FENIN_es
Este año online , el ENCUENTRO DEL SECTOR DE LA TECNOLOGIA SANITARIA tendrá el título: “La Transformación digital de la sanidad». 19 Mayo 2021, no te lo pierdas.
![]()
PROGRAMA
11:45-12:00h | Bienvenida Mario Lara, director de Esade Madrid
Mª Luz López – Carrasco, presidenta de Fenin
12.00-12.15h | Ponencia inaugural: «La transformación digital de la sanidad» Galo Gutiérrez Monzonís, director general de Industria y de la Pyme, Ministerio de Industria, Comercio y Turismo.
12.15-12.40h | Ponencias
– «Aplicación de la digitalización y la IA» Ángel Sánchez Aristi, director general de Digitalización e Inteligencia Artificial, Ministerio de Asuntos Económicos y Transformación Digital
– «Relevancia de la tecnología y las TIC en la transformación digital de la salud» Belén Soto, presidenta del Sector Salud Digital de Fenin
12.40-13.20h | Mesa redonda: «Desarrollo de la telemedicina en el escenario COVID-19» José Luis Baquero, director y coordinador científico del Foro Español de Paciente
– Luis Badrinas, director ejecutivo de Barcelona Health Hub
– Cristina Bescós, directora general de EIT Health Spain
Moderador: Manel Peiró, director del Institute for Healthcare Management de Esade
13.20-13.30h | Entrega de los premios VOLUNTADES
13:30 | Conclusiones y cierre

Feliz dia del trabajador – 1 de Mayo – agentes económicos productos sanitarios
Felicidades a todos los trabajadores del sector, dándolo todo para estos momentos difíciles de pandemia para que no falte nada en el Hospital y para que todo funcione cuando mas se necesita. Todo ello en una cuenta atrás para los nuevos reglamentos 26 de mayo de 2021 para MDR y 26 de mayo de 2022 para IVDR.
Jornada «IMPRESIÓN 3D EN HOSPITALES» by @COIIM participa la @SEEIC_spain 6 mayo 2021 – 17h
No os perdáis esta jornada donde tendremos la presentación de los requisitos reglamentarios de la impresión 3D en hospitales e intentaremos contar las diferencias entre las distintas opciones (a medida, in house, personalizado, adaptado, …) de los productos sanitarios en la participación de Xavier Canals Vicepresidente de la SEEIC.
Podeis inscribiros aqui (no es preciso ser colegiado):![]()

Jornada «Forum de talento en Ingenieria Biomedica» 5 Mayo 2021 by @FENIN_es @HT_Cluster @UniBarcelona @la_UPC @UPFabra
Interesante jornada organizada por las tres universidades de Barcelona que dan el grado de ingeniería biomédica conjuntamente con las organizaciones FENIN y HeathTech Cluster el formato virtual. Este año participamos desde Tecno-med. Nos vemos allí.
Symposium AEFI 10-11 Mayo 2021 by @AEFI_es con la participación de @Tecno_med
Como cada año tenemos una cita en el SYMPOSIUM AEFI https://www.aefi2021.com/
este año del 10 al 11 de Mayo de 2021, con la participación de Tecno-med en
TALLER 3 «Clasificando Productos Sanitarios para Diagnóstico in Vitro» – 10 mayo 13h45 a 15h15 y
TALLER 9 “Requisitos relativos a la información proporcionada con el producto según reglamentos MDR/IVDR» 11 mayo 15h a 16h
Ponentes: Xavier Canals Riera. Director Tecno-med Ingenieros y Claire Murphy. Socio Consultor Tecno-med Ingenieros ![]()
No te pierdas este evento, esperamos poder saludarte allí.
Jornada UDI online por @AECOC_es 23 Abril – 10h a 13h30 con la colaboración de @AEMPSgob y @FENIN_es
Formación online organizada por Sergi Vilella de AECOC sobre UDI para productos sanitarios, con la participación de dos referentes Carmen Ruiz-Villar Jefa del Departamento de Productos Sanitarios de la AEMPS y Maria Aláez Directora Técnica de FENIN, presentando las novedades sobre el próximo Real Decreto de Productos Sanitarios y la legislación europea.
Feliz dia de S. Jordi – 23 de Abril rosa y MDR
Formacion 22 abril «Electromedicina, equipos analizadores de IVD e implantables activos segun MDR e IVDR» en el curso de posgrado «Experto Productos Sanitarios» 2021 @UniBarcelona
No te pierdas esta formación si quieres ser PRCN con los nuevos reglamentos MDR e IVDR
Con la participación de Claire Murphy y Xavier Canals de Tecno-med Ingenieros como parte del equipo de profesores.
mas información: http://www.ub.edu/tecnofarm/tecnologia/masters-i-postgraus/#1500545361571-6159738d-5f5c
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
EUDAMED V2.8 – nueva versión que vuelve a mostrar los registros del modulo Devices
En esta nueva versión se incluyen mejoras en la búsqueda de productos y se incluyen sólo los ON notificados con MDR/IVDR. Al haber cambiado otra vez las fechas de obligatoriedad de EUDAMED se ha enfriado el numero de altas, os damos aqui algunos números relativos a España (19 julio 2022):
– nª de SRN asignados a agentes económicos = 1117
– nº de fabricantes españoles dados de alta = 475 de un TOTAL EU= 15374
– nº de importadores españoles dados de alta = 504 de un TOTAL EU= 4380
– nº de agrupadores españoles dados de alta = 36 de un TOTAL EU= 559
– nº de representantes autorizados españoles dados de alta = 102 de un TOTAL EU= 1572
– nº de productos de fabricantes españoles dados de alta = 1065 de un TOTAL EU= 93883
Además el modulo de ayuda se ha actualizado: https://webgate.ec.europa.eu/eudamed-help/en/getting-started.html
No te quedes fuera del directorio europeo de productos sanitarios: EUDAMED https://ec.europa.eu/tools/eudamed/
Inscribete en nuestro curso de formación:
2208 – SISTEMA DE IDENTIFICACIÓN ÚNICA UDI y BASE DE DATOS EUDAMED
a realizarle 8 de noviembre de 2022 para estar al dia.![]()

Boletin @AEMPSgob 2T 2022 de productos sanitarios
La AEMPS publica el boletin del segundo trimestre de 2022, esta vez sin incluir a los productos cosméticos. Que incluye los siguientes apartados:
– Actuaciones relacionadas con la crisis provocada por la COVID-19
– Legislación
– Vigilancia de productos sanitarios
– Control de productos sanitarios
– Otra información de interés
![]()
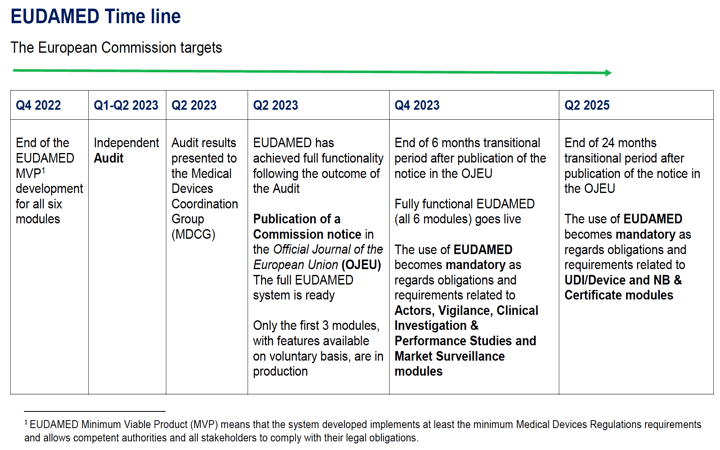
La Comisión publica una actualización de las fechas de desarrollo de EUDAMED con nuevo retraso de 1 año
La Comisión ha publicado una actualización de la planificación de la base de datos EUDAMED, en ella se establece el cuarto trimestre T4 (Q4 en inglés) de 2023 (antes Q4 2022), para la disponibilidad del EUDAMED MVP (mínimum viable product = sistema implementa los requisitos mínimos de los Reglamentos y permite que las autoridades competentes y todas las partes interesadas cumplan con sus obligaciones legales). Y la obligatoriedad de EUDAMED pasa a T2 2026 (antes Q2 2025).
Los plazos quedan así:
T4 2023 – EUDAMED MVP
T2 2024 – Publicación DOUE liberación EUDAMED por la Comisión – inicio de los 6 meses periodo transitorio
T4 2024 – EUDAMED obligatorio para módulos ACTORES, VIGILANCIA, INVESTIGACION_CLINICA y PMS
T2 2026 – fin 24 meses periodo transitorio – EUDAMED obligatorio módulos UDI-Device y Certificados-ON
Nuestra recomendación: nuestros datos de ACTORES y todos los productos MDR / IVDR subirlos a EUDAMED nada mas tenerlos. EUDAMED se convierte en un catalogo europeo de proveedores y productos y quien no esté puede pensarse que ha abandonado el sector.
Acordaros que desde 26 mayo 2021 para MDR y 26 mayo 2022 para IVDR los fabricantes tienen la obligación de asignar UDI-DI básico y UDI-DI aunque no tengan que incluirlo en su etiquetado e IFU, ni subirlos a EUDAMED.
este es el anterior plan:

La Comisión Europea publica la actualización del Rolling-plan (Jul-2022) para los reglamentos MDR e IVDR
Este plan de implementación contiene una lista de los actos de ejecución esenciales identificados y otras iniciativas relevantes que la Comisión ha adoptado o tiene la intención de adoptar en el futuro. Este plan se divide en dos secciones: actos de implementación y otras acciones / iniciativas. Este documento está sujeto a revisión periódica para proporcionar a las autoridades nacionales y a las partes interesadas la información más actualizada.
Seguiremos informando … 

MDCG: nueva MDCG 2022-12 Guia de practicas administrativas y soluciones técnicas alternativas hasta que EUDAMED este plenamente funcional para IVDR

Informe de impacto del proyecto de Real Decreto de productos sanitarios enviado por la @AEMPSgob a la Comisión Europea
Como parte del proceso de consulta previa para la aprobación del Real Decreto de productos sanitarios la AEMPS ha remitido además del texto del RD para su revisión a la Comisión, que ya publicamos, las aportaciones y su contestación pormenorizada por el departamento de productos sanitarios. Interesante para saber que cambios solicitaban las distintas partes interesadas. Nosotros participamos en varias de estas propuestas como asesores y felicitamos al Departamento por su gran trabajo.


impacto regulatorio-económico – contestación aportaciones

Publicado por la Comisión Europea el proyecto de Real Decreto de productos sanitarios recibido de la @AEMPSgob
Como parte del proceso de consulta previa para la aprobación del Real Decreto de productos sanitarios la AEMPS ha remitido el texto para su revisión a la Comisión. Este texto incluye las modificaciones elaboradas por el departamento de productos sanitarios en base a las aportaciones realizadas por las sociedades científicas, técnicas e industriales españolas. Interesante que revises los cambios para estar al día de los requisitos.

La Comisión Europea publica las especificaciones comunes para productos IVD clase D como Reglamento de Ejecución (UE) 2022/1107