PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación practica «2208 – Sistema de identificación única UDI y base de datos EUDAMED» 8 Nov 2022 9h-14h
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

38 Seminario de Ingeniería Hospitalaria. @AEIHorg 27 – 29 Oct 2021 Gijón – @XCanals Vicepresidente de la @SEEIC_spain participa en la mesa Imprime
Participamos en el evento el jueves 28 de Octubre de 9h a 10h en la Sala de Conferencias como ponente Xavier Canals Vicepresidente SEEIC en el Palacio de Congresos de Gijón (Paseo Dr. Fleming, 481 33201 Gijón, Asturias)
http://congresodeingenieriahospitalaria.com/gijon2021/

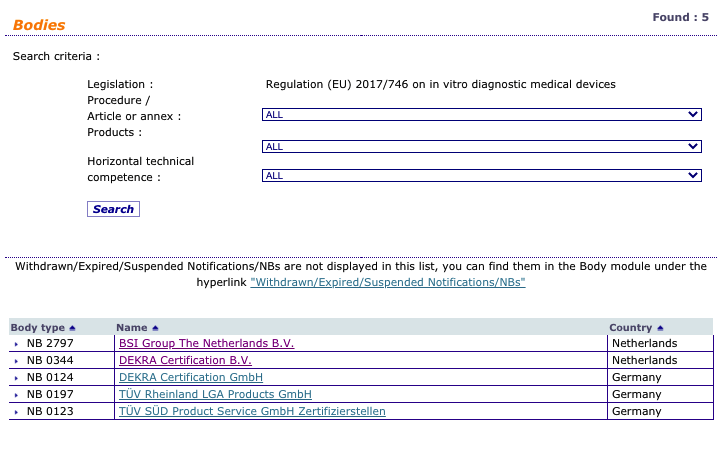
Organismos Notificados IVDR (6): GMED SAS Francia ON num. 0459 nuevo ON. Enhorabuena!!!
Nueva designación del Organismo Notificado:
GMED SAS
1, rue Gaston Boissier 75724 PARIS – France
Tel: +33 1 40 43 37 00 Fax : + 33 1 40 43 37 37
Email : info@lne-gmed.com
Website : https://lne-gmed.com/fr
puedes ver la lista en NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=35
y para MDR …
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34

Sigue el registro de actores en EUDAMED @EU_Health de actores españoles validados por la @AEMPSgob en septiembre se inicia el de productos

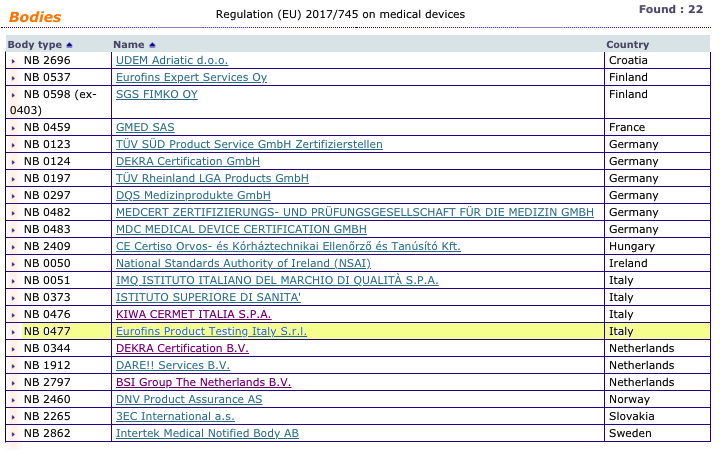
Organismos Notificados MDR (22): Eurofins Product Testing Italy (Italia) ON num. 0477 nuevo ON. Enhorabuena!!!
Nueva designación del Organismo Notificado:
Eurofins Product Testing Italy S.r.l.
Via Courgnè, 21, 10156 – TORINO (TO) Italy
Tel: : +39 011 2222225 – Fax : +39 011 2222226
Email : tech@eurofins.com
Website : http://tech.eurofins.it
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR … read more…

Jornadas @UIMP «Salud digital tras la COVID‐19: de lo imprevisto a la consolidación» participa @XCanals 22-23 julio 2021
No os perdáis esta jornada donde participamos en la mesa: «La perspectiva de la industria sobre la Transformación Digital en Sanidad» con los ponentes:
– D. Juan Carlos Ramos – Gerente Cluster TIC Cantabria TERA
– Dña. Marta Balenciaga – Decana‐Presidente Colegio Oficial Ingenieros de Telecomunicación (COIT)
– D. Xavier Canals Riera – Director Tecno-med Ingenieros SL
modera: D. Santiago García Blanco. Director General de Transformación Digital y Relaciones con los Usuarios![]()

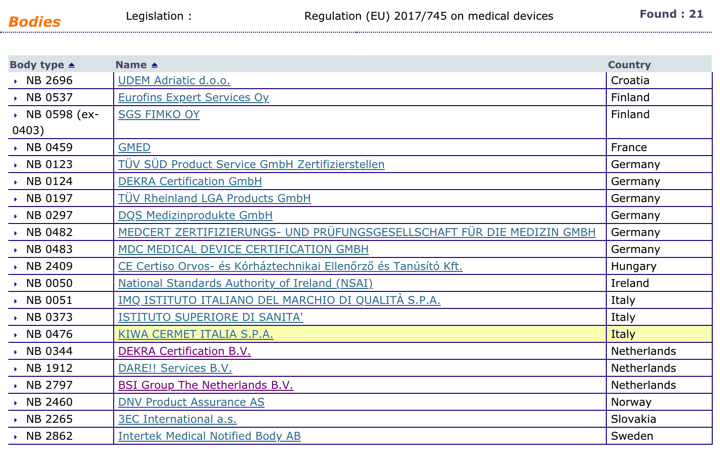
Organismos Notificados: KIWA CERMET(Italia) ON num. 0476 nuevo ON con MDR(21). Enhorabuena!!!
Nueva designación del Organismo Notificado
KIWA CERMET ITALIA S.P.A.
Via Cadriano, 23 – 40057 – Cadriano di Granarolo (BO) Italy
Phone : +39 051 4593111
Email : infobologna@kiwacermet.it
Website : www.kiwacermet.it
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR …

@TICsalut publica nueva edición de la guía para el desarrollo de apps «Desarrollo de aplicaciones móviles en el ámbito de la salud y la atención a la persona»
Se publica una nueva edición que incluye los nuevos reglamentos aunque sigue estando «desconectado» este requisito del resto de la guía, no aparecen las normas EN 62304 y EN 82304, …
En cambio los reglamentos MDR y IVDR si que piden protección de datos, ciberseguridad, integridad de datos y interoperabilidad.

Nueva guía FDA @FDAcdrhindustry para UDI

Congreso SEEIC virtual 22-23 Jun 2021 @SEEIC_spain – mesa 3 del nuevo Reglamento y Real Decreto con @AEMPSgob, @FENIN_es, @MedtronicES y el vicepresidente @XCanals
Mesa 3 – 23 junio 17h – 17h45 sobre la NUEVA LEGISLACION EUROPEA DE EQUIPOS ELECTROMEDICOS Y TECNOLOGIA SANITARIA MDR Y RD
Moderador: D. Xavier Canals Riera, Director Tecno-Med Ingenieros y Vicepresidente SEEIC.
– Dña. Carmen Ruiz-Villar Fernández-Bravo,Jefa del Departamento de PS – AEMPS.
– Dña. María Alaez, Directora Técnica FENIN.
– Dña. Marta Alonso Fernández, Regulatory & Quality Iberia Manager Medtronic
puedes ver las presentaciones y la grabación en el portal de formacion de la SEEIC https://training.seeic.org/course/index.php?categoryid=7
Dentro de las Jornadas @ClinicSchool 2021 participamos en «Innovación , transferencia del conocimiento: Observatori mHealth» – 2 jul 2021
10.15 – 11.45 h Taula Rodona 1. El repte de la integració de la mHealth
Modera: Sra. Imma Grau
– El repte. Sra. Imma Grau, Hospital Clínic Barcelona
– PRO I CON de mHealth en el seguiment de pacients. Sr. Hugo López, HCB
– Condicions a demanar a les Apps per a la intergració . Sr. Xavier Canals-Riera, Tecno-med Ingenieros
– Com connectar per a produir coneixemnt. Sr. Raimundo Lozano, HCB
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Búsqueda de certificados de Organismo Notificado CNCPS num. 0318 – https://certificaps.gob.es/organismo-notificado-0318/

Día Mundial del Farmacéutico 25’Set 2022 @AEFI_es @AEMPSgob @SANIDADgob – Felicidades a estos grandes profesionales !!!!
Este año, el Día Mundial del Farmacéutico tiene como lema «La Farmacia en acción, unida por un mundo mas saludable». Estos grandes profesionales tienen también una gran relevancia en los asuntos regulatorios que no es conocida frente a su labor pública de dispensación de medicamentos. Felicidades a estos profesionales que se agrupan en AEFI o como expertos en las distintas areas sanitarias de las CCAA y la AEMPS.

@MedtechEurope ( @FENIN_es ) publica el informe «The European Medical Technology Industry in figures 2022»

KPMG publica el informe «Medical Devices 2030»

MDCG: nueva MDCG 2022-15 de seguimiento para productos legacy certificados IVDD (anexo II y autodiagnóstico)

Publicados por el Mº Sanidad italiano sendos Decretos Ley para la adaptación de la legislación nacional italiana a MDR e IVDR
Publicados el 13 de septiembre en el Boletin Oficial, y entrando en vigor el 29 de septiembre, los Decretos legislativos que establecen los requisitos específicos para los productos sanitarios en Italia:
– los requisitos lingüísticos de la etiqueta y de las instrucciones de uso, (italiano)
– obligación de registro para los fabricantes de productos a medida y los distribuidores
– indicaciones para la publicidad y la venta online de productos
– se define un régimen sancionador por infracciones a las conductas previstas en el Reglamento.
Disposiciones posteriores del Ministerio de Salud definirán procedimientos operativos para el registro de fabricantes de productos a medida, métodos de notificación de incidentes por parte de los profesionales de la salud, almacenamiento de la UDI de dispositivos por parte de las instituciones de salud, presentación de comunicaciones relativas a investigaciones clínicas, definición de las funciones y composición del Observatorio Nacional de Precios de Dispositivos Médicos.
MDR – Decreto Legislativo 137/2022
IVDR – Decreto Legislativo 138/2022

Nueva actualización de la guía FDA (draft) para software utilizado en fabricación y sistemas de calidad @FDAdeviceInfo
La FDA ha publicado un borrador de la guía específica para software utilizado en fabricación (requisito 7.5.6 ISO 13485) y utilizo en sistemas de calidad (requisito 4.1.6 ISO 13485) esta guía reemplaza el capitulo 6 («Validation of Automated Process Equipment and Quality System Software») de su precedente «General Principles of Software Validation«. Incluye como ejemplos 1. Sistema de gestión de no conformidades, 2. Sistema de gestión del aprendizaje LMS y 3.Aplicaciones de inteligencia a negocios e incluye su análisis de riesgos y propuestas de acciones y su registro.
Léete esta propuesta …


MDCG: Revisión 1 de la MDCG 2021-22 «Aclaración sobre la ‘primera certificación para ese tipo de producto’ y los procedimientos correspondientes que deben seguir los organismos notificados» – IVDR

MDCG: recordatorio … la MDCG 2020-6 incluye en su anexo I la lista de secciones de la MEDDEV 2.7/1 relevantes para MDR
La MDCG publica este recordatorio para pedir paciencia a los que pedimos una MEDDEV 2.7/1 rev4 para MDR e IVDR, quiere pues complementar la MDCG 2020-6
Lo reproducimos aqui …
Appendix I – Sections of MEDDEV 2.7/1 rev. 4 which are still relevant under the MDR for the application of this guidance
The identified sections of MEDDEV 2.7/1 rev. 4 are considered relevant to MDR as they contain helpful information regarding how to perform activities associated with clinical evaluation:
– 6.4. Who should perform the clinical evaluation?
– 8. Identification of pertinent data (Stage 1)
– 9. Appraisal of pertinent data (Stage 2)
– 10. Analysis of the clinical data (Stage 3). This chapter includes references to the MDD, MDR requirements should be used instead
– A3. Device description – typical contents
– A4. Sources of literature
– A5. Literature search and literature review protocol, key elements
– A6. Appraisal of clinical data – examples of studies that lack scientific validity for demonstration of adequate clinical performance and/or clinical safety
– A7.2. Conformity assessment with requirement on acceptable benefit/risk profile
– A7.3. Conformity assessment with requirement on performance
– A7.4. Conformity assessment with requirements on acceptability of undesirable side-effects
– A10. Proposed checklist for the release of the clinical evaluation report.