PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2209 – Marcado CE MDR: Requisitos Europa Productos Sanitarios – Lecciones aprendidas» 13 Dic 2023 9h-14h
Fecha: 13 Dic 2022, 9h a 14h en webinar en directo y 25h en teleformación
Esperamos verte ahi … ![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
@TICsalut presenta una nueva edición de la guía para el desarrollo de apps «Desarrollo de aplicaciones móviles en el ámbito de la salud y la atención a la persona»
Reunión 17 sept 2021 MDCG WG13 ANNEX XVI para tratar las especificaciones comunes para productos sin finalidad médica

En esta reunión se han revisado las especificaciones comunes de obligada aplicación para productos de anexo XVI que se espera sean publicadas a primeros de 2022, entrando pues en aplicación en verano 2022. Otra reunión importante es la del 23 de septiembre de EUDAMED donde esperamos se apruebe la MDCG de udi’s para lentes de contacto.
Seguiremos informando
Feria dental IDS 2021 – 22 a 25 Septiembre – Colonia (Alemania) @IDScologne #IDS2021

IDS se llevará a cabo finalmente del 22 al 25 de septiembre incluyendo la nueva plataforma digital «IDSconnect», para permitir que los visitantes que aún se ven afectados por las restricciones de viaje en todo el mundo puedan participar en el IDS. El uso de esta será gratuito para todos los visitantes: https://www.english.ids-cologne.de/trade-fair/idsconnect/ 
Con 20 stands españoles (61 en la anterior edición) de aproximadamente 1000 stands, que representan uno de los sectores mas punteros en productos sanitarios del país, como cada 2 años presentan sus novedades en la feria mas importante del mundo.
read more…

Congreso #AIBigData21 by @CIDAI_eu 14 SET 2021 15h40-17h SECTOR SALUD
No os perdáis esta sesión de proyectos en salud y bienestar que organiza el CIDAI y en el que esperamos ver si se cita el tema regulatorio para los proyectos de salud para evitar la mezcla con los proyectos de bienestar. Ya hay varios softwares que incluyen AI marcados CE como productos sanitarios y su tratamiento así como otras áreas regulatorias como Australia y USA han puesto en sus guías en el caso europeo aun estamos a la espera. ![]()

Formacion gratuita “Como afrontar la regulacion de tu producto sanitario?” by @CIMTI_cat con la colaboración de @tecno_med
Para poder comercializar tu producto sanitario en Europa necesitarás obtener el marcado CE, de acuerdo con los reglamentos MDR y IVDR, y cumplir con los reales decretos que establecen los requisitos adicionales en España.
En esta formación, impartida por la consultora especializada Tecno-med, le explicaremos cuáles son los requisitos para poder vender su producto y le explicaremos las últimas novedades y actualizaciones relacionadas con las tres bases del marcado CE: read more…

Webinar «MedTech Startup’s Day #1 Regulatory» by @FENIN_es 9 septiembre 2021 – 10h
Desde la Plataforma Española de Innovación en Tecnología Sanitaria se han programado varias píldoras formativas dirigidas a emprendedores del sector de la Tecnología Sanitaria. Estas píldoras tendrán una duración aproximada de una hora y cubren los temas más relevantes que afectan a emprendedores y startups del sector. read more…

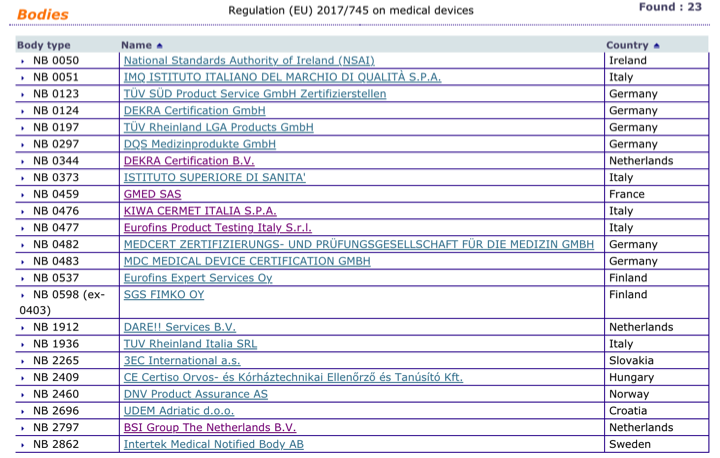
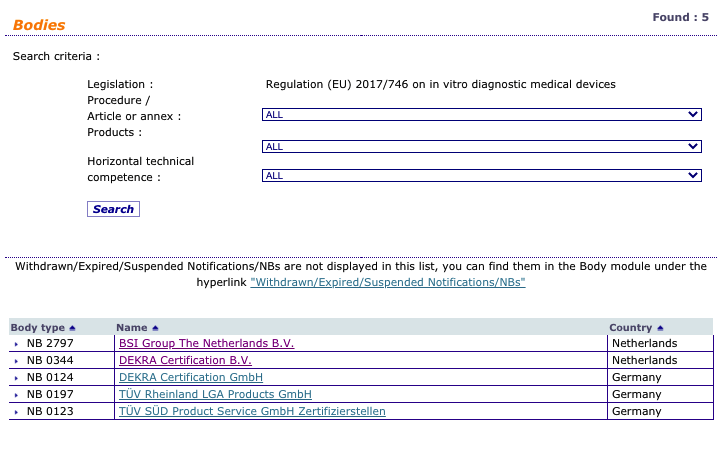
Organismos Notificados MDR (23): TUV Rheinland Italia (Italia) ON num. 1936 nuevo ON. Enhorabuena!!!
Nueva designación del Organismo Notificado:
TUV Rheinland Italia SRL
Via Mattei, 3, 20010 – Pogliano Milanese (MI), Italy
Tel. : +39 02 9396871
Email : informazioni@it.tuv.com
Website : www.tuvitalia.com
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR …

Feria dental IDS 2021 – 22 a 25 Septiembre – Colonia (Alemania) @IDScologne #IDS2021
IDS se llevará a cabo finalmente del 22 al 25 de septiembre incluyendo la nueva plataforma digital «IDSconnect», para permitir que los visitantes que aún se ven afectados por las restricciones de viaje en todo el mundo puedan participar en el IDS. El uso de esta será gratuito para todos los visitantes: https://www.english.ids-cologne.de/trade-fair/idsconnect/ 
Con 20 stands españoles (61 en la anterior edición) de aproximadamente 1000 stands, que representan uno de los sectores mas punteros en productos sanitarios del país, como cada 2 años presentan sus novedades en la feria mas importante del mundo.
read more…

El Organismo Notificado español @AEMPSgob 0318 se prepara para su designación para la MDR con la aplicación CNCps de tramitación electrónica de marcado CE
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha adoptado una iniciativa para que las diferentes empresas realicen los trámites relativos a la certificación de marcado CE y a la certificación de la norma ISO 13485 de forma telemática a través de la aplicación informática CNCps – Centro Nacional de Certificación de Productos Sanitarios en el sitio web: https://sinaem.agemed.es/CNCps/
read more…
@enginyersbcn organiza el Debate d’Enginyeria Biomèdica. «Regulatory affairs del sector productes sanitaris» – 03 Marzo 2022 18h30-20h online
La industria de la Salud y especialmente los Productos Sanitarios están experimentando una gran innovación en todos los países del mundo, así como también van creciendo las exigencias regulatorias impuestas por las autoridades sanitarias de los distintos países de las regiones USA, EU, Asia Pacific y Latam. Este Debate va orientado tanto a los profesionales del sector como a las nuevas generaciones de ingenieras/es en un formato para compartir experiencias, conocimientos y nuevos retos profesionales.
Contará con los ponentes:
Xavier Canals, Director a Tecno-Med Ingenieros
Júlia Oliva, Project Leader a Perdigó
Àngels Roma, Regulatory Affairs & Design Quality Director a Werfen
Presentación a cargo de Jordi Pujol, Subcomissió d’Enginyeria Biomèdica d’ENGINYERS BCN
Moderación a cargo de Carme Carrillo, IDD a Matachana Group.
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

Constitución del Grupo de Trabajo WG4 del comité ISO/TC 194 para el desarrollo de la norma ISO 18969 de evaluación clínica de productos sanitarios @normasUNE
MDCG: Revisión 1 de la MDCG 2020-10 «Guidance on safety reporting in clinical investigations under the MDR»
En esta MDCG 2020-10/1 Rev.1 se incluyen los siguientes cambios:
Section 3 new definitions
Section 4, intro clarification on filling in the reporting table
Section 5, table updated
Section 5.1 clarification on reporting duties
Section 5.2.2 internal reference
Section 9.4 clarification
Section 10.2.1 coding
Sections 10.2.15-17 new
Section 10.2.19-20 clarification

La MDCG publica la actualización del Joint Implementation Plan (Oct-2022) para IVDR
Como cada año nosotros sólo jugamos al 13485 en la lotería de Navidad !! – prueba nuestros servicios
MDCG: nueva MDCG 2022-16 de Guía para Representantes Autorizados según MDR e IDR
Boletin @AEMPSgob 3T 2022 de productos sanitarios
La Comisión Europea publica una actualización de la propuesta de reglamento para la Inteligencia Artificial que incluye software médico
La Comisión Europea publica la actualización del Rolling-plan (OCT-2022) para los reglamentos MDR e IVDR
Este plan de implementación contiene una lista de los actos de ejecución esenciales identificados y otras iniciativas relevantes que la Comisión ha adoptado o tiene la intención de adoptar en el futuro. Este plan se divide en dos secciones: actos de implementación y otras acciones / iniciativas. Este documento está sujeto a revisión periódica para proporcionar a las autoridades nacionales y a las partes interesadas la información más actualizada.
Seguiremos informando … 
SWISSDAMED base de datos Suiza para productos sanitarios (EUDAMED Suiza)
Suiza dispone ya de una base de datos que reproduce a la EUDAMED europea. Estos son sus características:
– Registro de actores y productos sanitarios comercializados en Suiza
– «Go live»: previsto para 2023
– swissdamed consta de dos módulos interconectados y un sitio web público
◦ 1. Liberación – Módulo Operadores Económicos
◦ 2. Liberación – Módulo UDI/Dispositivos
– Organismos emisores: GS1, IFA, HIBCC, ICCBBA (igual que la UE)
– Uso del concepto UDI básico (en línea con el sistema de la UE)
– Modelo de datos compatible con EUDAMED3![]()