PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2210 – Marcado CE IVDR: Requisitos Europa Productos Sanitarios – Lecciones aprendidas» 15 Dic 2022 9h-14h
Se ha adoptado y ha entrado en vigor el nuevo Reglamento de Productos Sanitarios para Diagnóstico In Vitro IVDR. Desde 26/05/2022 se aplica quedando derogada la Directiva 98/79/CE.
En esta formación revisamos todas las novedades focalizando en el impacto de estos cambios en los procedimientos actuales de Marcado CE de los productos sanitarios IVD, así como los requisitos del nuevo Real Decreto. Así mismo, planteamos los plazos de transición establecidos para la plena aplicación de los requisitos a lo largo de los próximos años. Revisaremos las lecciones aprendidas y los casos de éxito de productos marcados CE con IVDR.
Fecha: 15 Dic 2022, 9h a 14h en webinar en directo y 25h en teleformación
Esperamos verte ahi … ![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Exito de la Jornada Regulacion Tecnologia Sanitaria en USA by @FENIN_es con #CERE y @tecno_med
Con gran participación de fabricantes españoles se cerró esta jornada de FENIN. Esta grabada así que si alguno de vosotros no pudo asistir podéis verla (contactad con FENIN)
PROGRAMA
10:30 h. Bienvenida y Presentación. (5min.) ᐳ Borja Polo. International Fenin.
10.35 h. YOUR PATH TO INVESTMENT IN THE UNITED STATES. ᐳ Dña. Linda Caruso – Deputy Senior Commercial Officer, U.S. Embassy Spain – Embajada de los Estados Unidos de América en España read more…
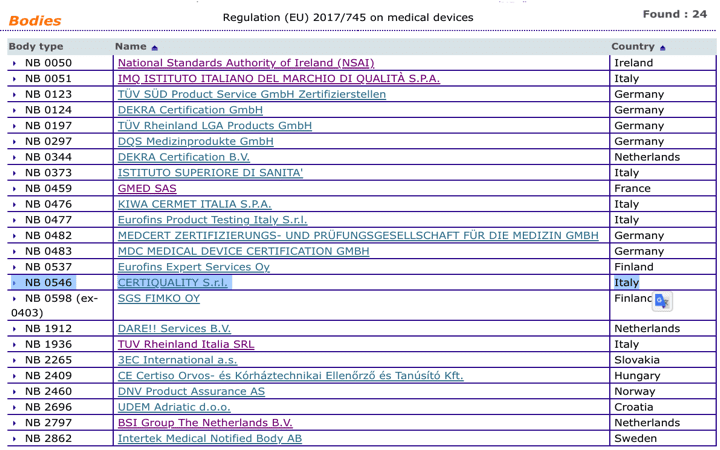
Organismos Notificados MDR (24): CERTIQUALITY (Italia) ON num. 0546 nuevo ON. Enhorabuena!!!
Nueva designación del Organismo Notificado:
CERTIQUALITY S.r.l.
Via G. Giardino, 4; 20123 – MILANO Italy
Phone : +39 02 8069171
Email : certiquality@certiquality.it
Website : www.certiquality.it
Notified Body number : 0546
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR …
38 Seminario de Ingeniería Hospitalaria. @AEIHorg 27 – 29 Oct 2021 Gijón – @XCanals Vicepresidente de la @SEEIC_spain participa en la mesa Imprime
Participamos en el evento el jueves 28 de Octubre de 9h a 10h en la Sala de Conferencias como ponente Xavier Canals Vicepresidente SEEIC en el Palacio de Congresos de Gijón (Paseo Dr. Fleming, 481 33201 Gijón, Asturias)
http://congresodeingenieriahospitalaria.com/gijon2021/
Reunión 19 oct 2021 MDCG en agenda punto 3.4 CS especificaciones comunes para productos sin finalidad médica An. XVI
En esta reunión se ha revisado el borrador final de las especificaciones comunes de obligada aplicación para productos de anexo XVI que se espera sean publicadas a primeros de 2022, entrando pues en aplicación en verano 2022 (a los 6 meses de su publicación). Ya veremos si se publica antes dado su avance.
Se publicará como Reglamento de ejecución con este indice:
Article 1 Scope and subject matter
Article 2 Transitional provisions
Article 3 Entry into force and date of application
ANNEX I applies to all the devices covered by Annexes II to VII. Risk Management General Requirements
ANNEX II applies to contact lenses listed in Section 1 of Annex XVI.Specific risks. Information for safety
ANNEX III applies to products listed in Section 2 of Annex XVI.Specific risks. Information for safety
ANNEX IV applies to products listed in Section 3 of Annex XVI.Specific risks. Information for safety
ANNEX V applies to products listed in Section 4 of Annex XVI.Specific risks. Information for safety
ANNEX VI applies to products listed in Section 5 of Annex XVI.Specific risks. Information for safety
ANNEX VII applies to products listed in Section 6 of Annex XVI.Specific risks. Information for safety
Seguiremos informando
Sesión formación «Reglamentación y normativa» en el Master en Ingeniería Biomédica 19 oct 2021 @UniBarcelona @UPC_School
nos vuelve a tocar nuestra clase … 19 Octubre 2021, 18h a 20h presencial. Nos invita el profesor Juan Ramos ( juanramoscastro@ub.edu ) como cada año.
Este año con los nuevos requisitos de los Reglamentos (EU) 2017/745 MDR y (EU) 2017/746 IVDR que ya están en vigor y cuyo periodo transitorio finaliza el 26 de mayo de 2020 y 26 de mayo de 2022 pero con «periodos de gracia» varios.
Con la participación de Claire Murphy y Xavier Canals de Tecno-med Ingenieros, este es el programa:


Jornada Regulacion Tecnologia Sanitaria en USA by @FENIN_es con #CERE y @tecno_med
No os perdáis esta jornada donde revisaremos los requisitos de la FDA para las tecnologías y productos sanitarios en USA contado por ponentes de: FENIN, CERE y TECNO-MED INGENIEROS. La Jornada es gratuita para los socios de Fenin y tiene un coste de 180 € para los no asociados. (La factura será girada una vez realice la inscripción.)
Tenemos el honor de participar Claire Murphy y Xavier Canals de Tecno-med
Programa … read more…
Día Mundial de la Normalización 14’Oct 2021 @NormasUNE @IECstandards @ISOstandards @ITU
Este año, el Día Mundial de la Normalización tiene como lema «Normas para los ODS objetivos de desarrollo sosteniblel». Con él, los organismos de normalización internacionales —la Organización Internacional de Normalización (ISO), la Comisión Electrotécnica Internacional (IEC) y la Unión Internacional de Telecomunicaciones (ITU) — han querido destacar como las normas han tenido una relevante contribución en la consecución de los 17 Objetivos de Desarrollo Sostenible (ODS) de la Agenda 2030 de Naciones Unidas.
38 Seminario de Ingeniería Hospitalaria. @AEIHorg 27 – 29 Oct 2021 Gijón – @XCanals Vicepresidente de la @SEEIC_spain participa en la mesa Imprime
Participamos en el evento el jueves 28 de Octubre de 9h a 10h en la Sala de Conferencias como ponente Xavier Canals Vicepresidente SEEIC en el Palacio de Congresos de Gijón (Paseo Dr. Fleming, 481 33201 Gijón, Asturias)
http://congresodeingenieriahospitalaria.com/gijon2021/
Congreso Internacional en Normalización, Estándares y Calidad Universitaria 5 y 6 Oct 2021 by @NormasUNE @AEMPSgob @FENIN_es

Esta edición incluye un apartado de normalización en salud y se celebra el 5 y 6 de octubre, de 15:30 h a 17:30 h con la participación de AEMPS y FENIN. La inscripción es gratuita y no presencial. read more…
La @AEMPSgob lanza un nuevo registro de productos sanitarios RENACER REgistro Nacional de dispositivos de Asistencia Circulatoria y Respiratoria
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

MDCG: actualizada MDCG 2022-18 Documento de posición sobre la aplicación del artículo 97 MDR a los productos legacy cuyo certificado MDD o AIMDD expira antes de la expedición de un certificado MDR
En esta publicación la MDCG detalla los pasos para aplicar el articulo 97 a los productos cuyo certificado con directiva ha vencido sin tener aun un certificado MDR. Ahora con el anexo que detalla que evidencias serán necesarias. Este es un caso en el que muchos fabricantes españoles se encuentran ahora debido a la falta de medios de los Organismos Notificados para realizar las evaluaciones de conformidad.


MDCG: nueva MDCG 2022-20 de modificación documentos de estudios de evaluación del funcionamiento bajo IVDR (leer con la MDCG 2022-19)
¿Nos olvidamos en la MDCG 2022-19? jajaja mucha prisa para dejar todos los borradores publicados antes de fin de año …
En esta publicación la MDCG detalla los documentos requeridos para la modificación de estudios de evaluación del funcionamiento según:
– Performance study application (IVDR Art. 58 (1&2))
– PMPF study notification (IVDR Art. 70(1))
– Performance study notification involving companion diagnostics using left-over samples only. (IVDR Art. 58(2))

MDCG: nueva MDCG 2022-19 de documentos de estudios de evaluación del funcionamiento bajo IVDR
En esta publicación la MDCG detalla los documentos requeridos para la realización de estudios de evaluación del funcionamiento según:
– Performance study application (IVDR Art. 58 (1&2))
– PMPF study notification (IVDR Art. 70(1))
– Performance study notification involving companion diagnostics using left-over samples only. (IVDR Art. 58(2))
Organismos Notificados MDR (36): ICIM S.P.A. (Italia) ON num. 0425 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
ICIM S.P.A.
Piazza Don Enrico Mapelli, 75 20099 – Sesto San Giovanni (MI) Italy
Phone : +39 02 725341
Email : info@icim.it
Website : www.icim.it
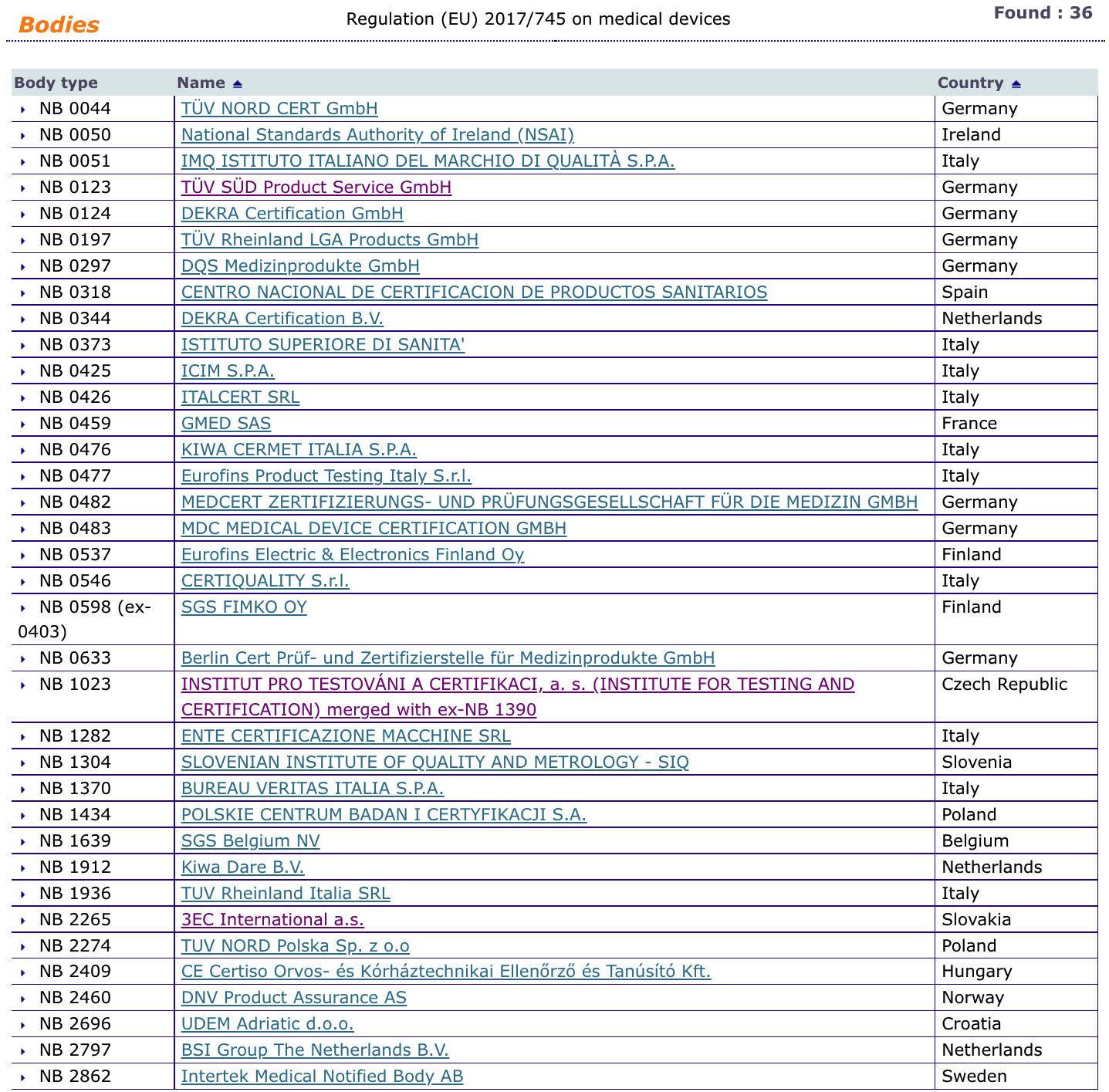
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR …

MDCG: nueva MDCG 2022-17 de Auditorias hibridas
En esta publicación la MDCG detalla los requisitos para las auditorias hibridas que define en el propio documento como:
«Una «auditoría híbrida» debe entenderse como una auditoría en las instalaciones del fabricante o de su proveedor(es) y/o subcontratista(s) con al menos un auditor presente en las instalaciones y otros miembros del equipo de auditoría que participan desde otro lugar utilizando las tecnologías de la información y la comunicación (TIC).»
![]()

Propuesta Reglamentos delegados para MDR e IVDR alargando los periodos de re-evaluación de los ON

Reglamentos: ¿Se ampliaran los plazos? La Comisaria Stella Kyriakides de EUHealth anuncia que se trabaja en una posición común – Consejo 9 diciembre ?
En el pleno del Parlamento Europeo (24/11/2022) la Comisaria del sector anunció que se estaba estudiando una posición común de todos los países miembros para poder aplicar caso a caso medidas de prórroga de certificados legacy, y como este próximo 9 de diciembre tenemos una sesión del Consejo de Sanidad que incluye en sus agenda un punto sobre «Aplicación del Reglamento sobre productos sanitarios. Información de la Comisión» veremos si hay novedad.
Seguiremos informando …

Suiza reconocerá los productos aprobados por la FDA