PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2301A – PRODUCTOS SIN FIN MEDICO DE ANEXO XVI MDR» cuenta atrás para DoA 22jun2023 – 13 febrero 2023 9h-11h
Ya se han publicado las especificaciones comunes para los productos sanitarios de anexo XVI que incluyen a los equipos electroestéticos, comenzando la cuenta atrás para la fecha de aplicación (DoA) a los mismos que es 22 junio 2023. Hay unos plazos transitorios que dependen del producto, los detallamos aqui.
En esta formación revisamos los requisitos de estos productos y las diferencias con los productos MDR convencionales.
Fecha: 13 Febrero 2023, 9h a 11h en webinar en directo y 10h en teleformación
Esperamos verte ahi … ![]()
coste: 195 Eur read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Exito de la RMD 2022 EAAR Annual Conference on New Medical Device Regulations 2-3 Feb 2022 con la participación como ponente de @CMurphy_tmi de @tecno_med
Con éxito de participación y tocando los temas mas debatidos de los reglamentos se celebró este evento con la participación de la Comisión Europea, Medtech, EAAR, Qserve, Emergo, Axon, Qarad, Informa y Tecno-med.
Claire Murphy presentó el tema de «Requisitos Generales de Seguridad y Funcionamiento».
Este es el programa read more…
Curso Intensivo «Regulación de productos sanitarios IVD bajo el nuevo reglamento 2017/746» by @FENIN_es participa @tecno_med
No os perdáis esta curso justo en la cuenta atrás de la fecha de aplicación de la IVDR. La inscripción es de 120 Eur para los socios de Fenin y de 480 Eur para los no asociados.
Tenemos el honor de participar Claire Murphy y Xavier Canals de Tecno-med en la sesión de «Clasificación de productos sanitarios IVDR»
Programa … read more…
Publicado en el DOUE el Reglamento 2022/112 modificacion del IVDR
Publicado con carácter de urgencia y entrando en vigor el mismo dia de publicación 28 de Enero de 2022 el reglamento 2022/112 por el que se modifican las disposiciones transitorias del IVDR.
TEXTO Reglamento 2022/112 MODIFICACION EN ESPAÑOL
Estas son las modificaciones (en rojo):
Artículo 110 Disposiciones transitorias
1. A partir del 26 de mayo de 2022, será nula toda publicación de una notificación relativa a un organismo notificado con arreglo a la Directiva 98/79/CE.
2. Los certificados expedidos por organismos notificados de conformidad con la Directiva 98/79/CE con anterioridad al 25 de mayo de 2017 seguirán siendo válidos hasta el final del período en ellos indicado, a excepción de los certificados expedidos con arreglo al anexo VI de la Directiva 98/79/CE, que serán nulos, a más tardar, el 27 de mayo de 2025.
Los certificados expedidos por organismos notificados de conformidad con la Directiva 98/79/CE a partir del 25 de mayo de 2017 serán nulos, a más tardar, el 27 de mayo de 2025.
3. No obstante lo dispuesto en el artículo 5 del presente Reglamento, un producto con un certificado expedido de conformidad con la Directiva 98/79/CE y que es válido en virtud del apartado 2 del presente artículo únicamente puede ser introducido en el mercado o puesto en servicio siempre que a partir de la fecha de aplicación del presente Reglamento siga cumpliendo con dicha Directiva, y a condición de que no haya cambios significativos en el diseño y en la finalidad prevista. No obstante, los requisitos del presente Reglamento relativos al seguimiento post comercialización, el control del mercado, la vigilancia, el registro de los agentes económicos y de los productos seguirán aplicándose y sustituirán a los correspondientes requisitos en dicha Directiva. Sin perjuicio del Capítulo IV y del apartado 1 del presente artículo, el organismo notificado que haya expedido el certificado a que se refiere el párrafo primero seguirá siendo responsable del control adecuado respecto de la totalidad de los requisitos aplicables relativos a los productos que certificó.
3. Como excepción a lo dispuesto en el artículo 5 del presente Reglamento, los productos mencionados en los párrafos segundo y tercero del presente apartado podrán introducirse en el mercado o ponerse en servicio hasta las fechas establecidas en dichos párrafos, siempre que, a partir de la fecha de aplicación del presente Reglamento, esos productos sigan cumpliendo con la Directiva 98/79/CE y a condición de que no haya cambios significativos en el diseño y en la finalidad prevista de esos productos.
Los productos con un certificado expedido de conformidad con la Directiva 98/79/CE y que sea válido en virtud del apartado 2 del presente artículo podrán introducirse en el mercado o ponerse en servicio hasta el 26 de mayo de 2025.
Los productos cuyo procedimiento de evaluación de la conformidad con arreglo a la Directiva 98/79/CE no haya requerido la participación de un organismo notificado, para los que se haya elaborado una declaración de conformidad antes del 26 de mayo de 2022 con arreglo a dicha Directiva y para los cuales el procedimiento de evaluación de la conformidad con arreglo al presente Reglamento requiera la participación de un organismo notificado, podrán introducirse en el mercado o ponerse en servicio hasta las fechas siguientes:
a) el 26 de mayo de 2025 en el caso de los productos de la clase D;
b) el 26 de mayo de 2026 en el caso de los productos de la clase C;
c) el 26 de mayo de 2027 en el caso de los productos de la clase B;
d) el 26 de mayo de 2027 en el caso de los productos de la clase A introducidos en el mercado en condiciones estériles.
Como excepción a lo dispuesto en el párrafo primero del presente apartado, los requisitos del presente Reglamento relativos al seguimiento poscomercialización, el control del mercado, la vigilancia, el registro de los agentes económicos y de los productos se aplicarán a los productos mencionados en los párrafos segundo y tercero del presente apartado, en lugar de los requisitos correspondientes de la Directiva 98/79/CE. Sin perjuicio del capítulo IV y del apartado 1 del presente artículo, el organismo notificado que haya expedido el certificado a que se refiere el párrafo segundo del presente apartado seguirá siendo responsable del control adecuado respecto de la totalidad de los requisitos aplicables relativos a los productos que certificó
4. Los productos que hayan sido introducidos legalmente en el mercado de conformidad con la Directiva 98/79/CE con anterioridad al 26 de mayo de 2022 y los productos que hayan sido introducidos en el mercado a partir del 26 de mayo de 2022 en virtud de un certificado tal como se indica en el apartado 2 del presente artículo, podrán seguir comercializándose o ser puestos en servicio hasta el 27 de mayo de 2025.
4. Los productos que hayan sido introducidos legalmente en el mercado de conformidad con la Directiva 98/79/CE con anterioridad al 26 de mayo de 2022 podrán seguir comercializándose o ser puestos en servicio hasta el 26 de mayo de 2025. Los productos que hayan sido introducidos legalmente en el mercado a partir del 26 de mayo de 2022 en virtud del apartado 3 del presente artículo, podrán seguir comercializándose o ser puestos en servicio hasta las fechas siguientes: a) el 26 de mayo de 2026 en el caso de los productos mencionados en el apartado 3, párrafo segundo, o párrafo tercero, letra a); b) el 26 de mayo de 2027 en el caso de los productos mencionados en el apartado 3, párrafo tercero, letra b); c) el 26 de mayo de 2028 en el caso de los productos mencionados en el apartado 3, párrafo tercero, letras c) y d).
5. No obstante lo dispuesto en la Directiva 98/79/CE, los productos que cumplan el presente Reglamento podrán introducirse en el mercado antes del 26 de mayo de 2022.
6. No obstante lo dispuesto en la Directiva 98/79/CE, podrán designarse y notificarse organismos de evaluación de la conformidad que cumplan el presente Reglamento con anterioridad al 26 de mayo de 2022. Los organismos notificados que se designen y notifiquen con arreglo al presente Reglamento podrán aplicar los procedimientos de evaluación de la conformidad que este establece y expedir certificados de conformidad con el mismo con anterioridad al 26 de mayo de 2022.
7. En lo que respecta a los productos sujetos a los procedimientos establecidos en el artículo 48, apartados 3 y 4, se aplicará el apartado 5 del presente artículo siempre que se hayan efectuado los nombramientos necesarios para el MDCG y los paneles de expertos y los laboratorios de referencia de la UE.
8. No obstante lo dispuesto en el artículo 10 y en el artículo 12, apartado 1, letras a) y b), de la Directiva 98/79/CE, los fabricantes, representantes autorizados, importadores y organismos notificados que, durante el período que se inicia en la fecha más tardía indicada en el artículo 113, apartado 3, letra d), y que finaliza dieciocho meses después, cumplan lo dispuesto en el artículo 27, apartado 3, en el artículo 28, apartado 1, y en el artículo 51, apartado 5, del presente Reglamento, se considerarán conformes con las disposiciones legales y reglamentarias adoptadas por los Estados miembros con arreglo al artículo 10 y al artículo 12, apartado 1, letras a) y b), de la Directiva 98/79/CE, tal como se especifica en la Decisión 2010/227/UE.
9. Las autorizaciones concedidas por las autoridades competentes de los Estados miembros con arreglo al artículo 9, apartado 12, de la Directiva 98/79/CE mantendrán la vigencia que en ellas se indique. 10. Hasta que la Comisión haya designado, con arreglo al artículo 24, apartado 3, a las entidades emisoras de identificaciones únicas del producto, GS1, HIBCC y ICCBBA se considerarán entidades emisoras designadas.
…
Artículo 112 Derogaciones
Sin perjuicio del artículo 110, apartados 3 y 4, del presente Reglamento, y sin perjuicio de las obligaciones de los Estados miembros y de los fabricantes sobre la vigilancia y de las obligaciones de los fabricantes sobre la disponibilidad de la documentación en virtud de la Directiva 98/79/CE, dicha Directiva queda derogada con efectos a partir del 26 de mayo de 2022 con excepción de lo siguiente:
a) el artículo 11, el artículo 12, apartado 1, letra c) y el artículo 12, apartados 2 y 3, de la Directiva 98/79/CE, y las obligaciones relativas a la vigilancia y estudios del funcionamiento previstos en los correspondientes anexos, que quedan derogados con efectos a partir de la más tardía de las fechas indicadas en el artículo 113, apartado 2 y el artículo 113, apartado 3, letra f), del presente Reglamento y
b) el artículo 10 y el artículo 12, apartado 1, letras a) y b), de la Directiva 98/79/CEE y las obligaciones relativas a la vigilancia y estudios del funcionamiento previstos en los correspondientes anexos, que quedan derogados con efectos a partir de los dieciocho meses desde la más tardía de las dos fechas indicadas en el artículo 113, apartado 2, y el artículo 113, apartado 3, letra f).
En cuanto a los productos mencionados en el artículo 110, apartado 3 y 4, del presente Reglamento, la Directiva 98/79/CE seguirá aplicándose hasta el 26 de mayo de 2028 en la medida en que sea necesario para la aplicación de dichos apartados.
La Decisión 2010/227/UE, adoptada en aplicación de las Directivas 90/385/CEE, 93/42/CEE y 98/79/CE, queda derogada con efectos a partir de la más tardía de las fechas indicadas en el artículo 113, apartado 2, y en el artículo 113, apartado 3, letra f), del presente Reglamento.
Las referencias a la Directiva derogada se entenderán hechas al presente Reglamento con arreglo a la tabla de correspondencias que figura en el anexo XV.
Artículo 113 Entrada en vigor y fecha de aplicación
1. El presente Reglamento entrará en vigor a los veinte días de su publicación en el Diario Oficial de la Unión Europea.
2. Será aplicable a partir del 26 de mayo de 2022.
3. No obstante lo dispuesto en el apartado 2:
a) el artículo 27, apartado 3, y el artículo 51, apartado 5, serán aplicables a partir del 27 de noviembre de 2023;
b) los artículos 31 a 46 y el artículo 96 serán aplicables a partir del 26 de noviembre de 2017. No obstante, a partir de dicha fecha hasta el 26 de mayo de 2022 las obligaciones de los organismos notificados con arreglo a lo dispuesto en los artículos 31 a 46 serán aplicables únicamente a los organismos que presenten una solicitud de designación de conformidad con el artículo 34;
c) el artículo 97 será aplicable a partir del 26 de mayo de 2018;
d) el artículo 100 será aplicable a partir del 25 de noviembre de 2020;
e) para los productos de la clase D, el artículo 24, apartado 4, será aplicable a partir del 26 de mayo de 2023. Para los productos de las clases B y C, el artículo 24, apartado 4, será aplicable a partir del 26 de mayo de 2025. Para los productos de la clase A, el artículo 24, apartado 4, será aplicable a partir del 26 de mayo de 2027.
f) Sin perjuicio de las obligaciones de la Comisión con arreglo al artículo 34 del Reglamento (UE) 2017/745, cuando, por circunstancias que no pudieran razonablemente preverse al elaborar el plan contemplado en el artículo 34, apartado 1, de dicho Reglamento, Eudamed no sea plenamente operativo el 26 de mayo de 2022, las obligaciones y los requisitos que se refieren a Eudamed serán aplicables a partir de la fecha correspondiente a seis meses después de la fecha de publicación del anuncio mencionado en el artículo 34, apartado 3, de dicho Reglamento. Las disposiciones a que se refiere la frase precedente son las siguientes: — el artículo 26, — el artículo 28, — el artículo 29, — el artículo 36, apartado 2, segunda frase, — el artículo 38, apartado 10, — el artículo 39, apartado 2, — el artículo 40, apartado 12, párrafo segundo, — el artículo 42, apartado 7, letras d) y e), — el artículo 49, apartado 2, — el artículo 50, apartado 1, — los artículos 66 a 73, — el artículo 74, apartados 1 a 13, — los artículos 75 a 77, — el artículo 81, apartado 2, 5.5.2017 ES Diario Oficial de la Unión Europea L 117/257 — los artículos 82 y 83, — el artículo 84, apartados 5, 7 y 8, párrafo tercero, — el artículo 85, — el artículo 88, apartados 4, 7 y 8, — el artículo 90, apartados 2 y 4, — el artículo 92, apartado 2, última frase, — el artículo 94, apartado 4, — el artículo 110, apartado 3, párrafo primero, segunda frase, Hasta que Eudamed sea totalmente operativa, las correspondientes disposiciones de la Directiva 98/798/CE seguirán siendo de aplicación a efectos de cumplir las obligaciones establecidas en las disposiciones enumeradas en el párrafo primero de la presente letra relativas al intercambio de información incluida, y en particular, la información referente a estudios del funcionamiento, informes de vigilancia, registro de los productos y agentes económicos, y notificaciones de certificados.
g) El procedimiento establecido en el artículo 74 será aplicable a partir del 26 de mayo de 2027, sin perjuicio de lo dispuesto en el artículo 74, apartado 14.
h) El artículo 110, apartado 10, se aplicará a partir del 26 de mayo de 2019.
i) el artículo 5, apartado 5, letras b), c) y e) a i), será aplicable a partir del 26 de mayo de 2024;
j) el artículo 5, apartado 5, letra d), será aplicable a partir del 26 de mayo de 2028.
Intentamos resumiros aqui siguiendo el texto de la propuesta:
1. fecha de aplicación general IVDR sin cambios: 26 mayo 2022 pero sólo aplica a clase A (sin intervención de ON) y nuevos productos introducidos en el mercado.
La comercialización o puesta en servicio de estos productos por distribuidores introducidos en el marcado antes de 26 de mayo 2022 podrá realizarse hasta 26 mayo 2025.
2. productos legacy IVD certificados (ps ivd con certificado IVDD de ON, de anexo II y autodiagnostico) se extiende hasta 27 mayo 2025 (antes 2024).
La comercialización o puesta en servicio de estos productos por distribuidores podrá realizarse hasta 26 mayo 2025.
3. productos legacy IVD (ps ivd que pasan a precisar ON con IVDR) se extiende el plazo de 26 mayo 2022 a los siguientes:
– clase D 27 mayo 2025
– clase C 27 mayo 2026
– clase B y A estériles 27 mayo 2027
en ambos casos legacy (2 y 3) sin cambios significativos en el producto, cumpliendo PMS y PMV de IVDR y cumpliendo los requisitos de registro.
La comercialización o puesta en servicio de estos productos por distribuidores se extiende el plazo a los siguientes:
– clase D 26 mayo 2026
– clase C 26 mayo 2027
– clase B y A estériles 26 mayo 2028.
4. productos in-house o LDT pasan a extender los plazos hasta 27 mayo 2024 para los requisitos como el sistema de calidad ISO 15189 y hasta 26 mayo 2028 para la necesidad de justificar que no hay un producto equivalente en el mercado.

Publicación en revista UNE «CTN 111 Aparatos y dispositivos médicos y quirúrgicos»
Calendario Reuniones de Trabajo de la MDCG (Grupo de Coordinación de Productos Sanitarios) 2022
Feria @Arab_Health 2022 – 24 a 27 Enero 2022 (5 Enero a 28 Febrero online)
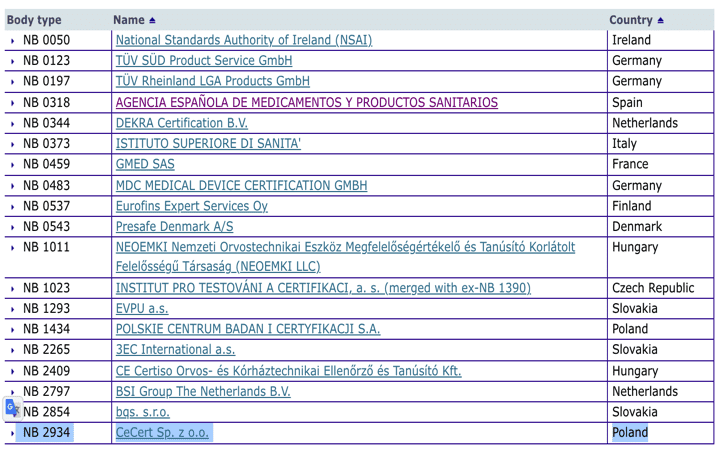
Organismos Notificados IVDD (si, no es una errata con la directiva 98/79): CeCert (Polonia) ON num. 2934 nuevo ON para directiva IVD
Si tenemos un productos sanitario de diagnóstico in vitro de lista A o lista B o bien de autodiagnóstico, tenemos un nuevo ON con ganas de aprovechar este tiempo hasta 26 de mayo de 2022. Posiblemente dedicado a kits de COVID lo veremos pronto en las cajas de tests de antígenos y de anticuerpos.
Con seis meses de antelación a la fecha de aplicación pero viendo un posible negocio por los nuevos periodos de gracia de la IVDR se ha incorporado a la lista de Organismos Notificados IVDD :
CeCert Sp. z o.o.
ul. Żurawia 32/34 lok.49, Warszawa, Polonia
Email : biuro@cecert.pl
Website : https://www.cecert.pl
Organismos Notificados MDR (27): ITALCERT SRL (Italia) ON num. 0425 nuevo ON. Enhorabuena !!!
Nueva designación del Organismo Notificado:
ITALCERT SRL
Viale Sarca, 336 20126 – MILANO – Italy
Phone : +39 02 66104876
Email : italcert@italcert.it
Website : www.italcert.it
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR … read more…
Organismos Notificados MDR (27): ITALCERT SRL (Italia) ON num. 0425 nuevo ON. Enhorabuena !!!
Nueva designación del Organismo Notificado:
ITALCERT SRL
Viale Sarca, 336 20126 – MILANO – Italy
Phone : +39 02 66104876
Email : italcert@italcert.it
Website : www.italcert.it
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR … read more…

La @MHRAdevices publica nueva guía sobre el uso de datos del mundo real en las investigaciones clínicas
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

La AEMPS publica la Nota informativa 1/2023 sobre las nuevas tasas y precios públicos en la ley 38/2022 que modifica el RDL 1/2015 – @AEMPS_gob
La AEMPS ha publicado la nota infromativa 1/2023 sobre las tasas 2023 indicando (como ya habiamos comentado):
- Las tasas vigentes, contenidas en el título XI del texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, aprobado por el Real Decreto Legislativo 1/2015, de 24 de julio, se continuarán aplicando hasta el próximo mes de junio.
- Los cambios contenidos en el texto del Artículo 123. Cuantía y particularidades que afectan al cálculo de la tasa de la Ley 38/2022, de 27 de diciembre, entrarán en vigor en junio de 2023. Por lo tanto, como se ha comentado anteriormente, las tasas se seguirán tratando como hasta la fecha.
- No se ha procedido a llevar a cabo ningún incremento anual en los importes de las tasas para el año 2023, por lo que las tasas abonadas en el pasado mes de diciembre seguirán siendo válidas en los plazos establecidos en el artículo 125.4 del Real Decreto Legislativo 1/2015, de 24 de julio.

Real Decreto de productos sanitarios 2023 @AEMPSgob – publicado dictamen del Consejo de Estado

La AEMPS publica la guía de aplicación en España del artículo 97 MDR (según MDCG 2022-18) para productos legacy cuyo certificado MDD o AIMDD expira antes de la expedición de un certificado MDR
En esta publicación la AEMPS detalla los pasos para aplicar el articulo 97 a los productos cuyo certificado con directiva ha vencido sin tener aun un certificado MDR pese a los esfuerzos llevados a cabo por el fabricante. Con este documento el Departamento de Productos Sanitarios de la AEMPS y su Directora Carmen Ruiz-Villar se posiciona con las Autoridades Sanitarias en la ayuda a los fabricantes nacionales que el sector agradece.
En caso de que la AEMPS considere que se cumplen los requisitos para la aplicación del artículo 97, se enviará una comunicación escrita al solicitante en la que se indicará el plazo máximo en el que se deberá poner fin al incumplimiento y los requisitos que se deben de cumplir para poder continuar introduciendo el producto en el mercado y comercializándose en la Unión Europea hasta dicha fecha. Hay que tener en cuenta que las autoridades competentes de otros países de la UE podrán adoptar otras medidas en sus mercados nacionales para otros agentes económicos relacionados con los productos. El fabricante no deberá realizar ningún cambio en el etiquetado del producto, incluido el marcado CE. Una vez recibida la comunicación, el solicitante deberá remitir a la AEMPS en un plazo de 1 semana una copia de la carta que el fabricante facilitará a los distribuidores y, en su caso, a los importadores del producto en la que se informa de la aceptación de la solicitud y del plan de acción que éste va a llevar a cabo para corregir la no conformidad. Teniendo en cuenta la naturaleza del producto y los riesgos asociados a este, la AEMPS podrá además solicitar que se remita en el mismo plazo una copia de una carta dirigida a los usuarios en la que se informe del incumplimiento y de las medidas adoptadas para poner fin al mismo, que posteriormente el fabricante deberá de facilitar a los usuarios. ![]()

Propuesta modificación Reglamentos: Actualizado (acortado) plazo comentarios de 11 enero a 18 enero 2023 …
Una vez la Comisión Europea publicó la propuesta de reglamento de modificación de los reglamentos MDR e IVDR en lo que respecta a las disposiciones transitorias para determinados productos sanitarios. ver nota de prensa en español – factsheet propuesta (eng) ahora siguiendo el tramite reglamentario se abre el periodo de comentarios que pueden realizarse tanto por particulares como por asociaciones del sector y profesionales. Este es el hipervinculo: https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13684-Extension-of-the-transition-period-for-medical-devices_es
Después pasará al Consejo y Parlamento Europeo …
Seguiremos informando … 

MDCG: publicada nueva MDCG 2023-2 para productos in-house
El artículo 50 del Reglamento (UE) 2017/745 sobre productos sanitarios (MDR) y el artículo 46 del Reglamento (UE) 2017/746 sobre productos sanitarios para diagnóstico in vitro (IVDR) establecen el requisito de que los Organismos Notificados pongan a disposición del público sus tarifas estándar para las actividades de evaluación de la conformidad que lleven a cabo y las pondrán a disposición del público.
Esta guía establece una tabla de calculo de costes que intenta facilitar la comparación de costes y que la puesta a disposición sea en la pagina web que aparece en NANDO y en el mismo idioma de la pagina.

MDCG: publicada nueva MDCG 2023-01 para productos in-house

Reglamentos: Publicada la propuesta de reglamento modificando MDR e IVDR con la ampliación de los periodos transitorios
Tal y como anunció la Comisaria Stella Kyriakides en la reunión del Consejo de Europa EPSCO Sanidad de 9 diciembre 2022 se ha publicado la propuesta de reglamento de modificación de los reglamentos MDR e IVDR en lo que respecta a las disposiciones transitorias para determinados productos sanitarios y productos sanitarios para diagnóstico in vitro

Ley 28/2022 de startups

La AEMPS publica las nuevas tasas y precios públicos en la ley 38/2022 que modifica el RDL 1/2015 – @AEMPS_gob
El 28 de diciembre (no es inocentada) se publicó en el BOE la ley 38/2022 que en su Disposición final sexta establece la modificación del texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, aprobado por el Real Decreto Legislativo 1/2015, de 24 de julio cambiando el TÍTULO XI de Tasas :
«Artículo 119. Creación, normativa y ámbito territorial.
1. Se crea la tasa por prestación de servicios y realización de actividades de la Administración General del Estado en materia de medicamentos, productos, productos cosméticos y productos de cuidado personal.
2. El tributo regulado en este Título se regirá por lo establecido en esta ley, en su defecto, por la Ley 8/1989, de 13 de abril, de Tasas y Precios Públicos, y disposiciones reglamentarias de desarrollo.
3. Dicha tasa será de aplicación en todo el territorio nacional de acuerdo con lo previsto en el artículo 124, y sin perjuicio de las facultades que correspondan a las Comunidades Autónomas.
…
Grupo V. Productos sanitarios, cosméticos y productos de cuidado personal
…