PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formacion «2303C – REAL DECRETO 192/2023 DE PRODUCTOS SANITARIOS» 21 Abril 2023 10h-13h @tecno_med
Ya tenemos el nuevo Real Decreto 192/2023 de productos sanitarios. En esta formación, revisaremos las novedades del mismo así como el impacto de los requisitos reglamentarios en toda la cadena de suministro
fecha: 21 Abri 2023, 10h a 13h en webinar en directo y 25h en teleformación ![]()
Esperamos verte ahi …
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

Pitch Day @UAM_Madrid de su programa Emprende 13 julio 2022 by @UAM_emprende @Genesis_Biomed
El programa está destinado a impulsar la creación de Spin-Offs basadas en el conocimiento generado por la UAM y sus centros de investigación. Para ello, se cuenta con investigadores punteros que desarrollan soluciones en diferentes áreas de la salud y la medicina. El programa corre a cargo del Vicerrectorado de Transferencia, Innovación y Cultura de la UAM con la colaboración de GENESIS Biomed. Desde Tecno-med hemos tenido el honor de participar como mentores en esta iniciativa que esperamos sea un éxito.
Se contarán los avances que han logrado los investigadores para convertir sus proyectos o líneas de investigación en un modelo de negocio adaptado a las necesidades del mercado. El evento se realiza presencialmente en la UAM, Campus de Cantoblanco, Edificio de Rectorado, C/Einstein 3, 28049 Madrid, Planta5, Sala G, y también se puede asistir de forma online de 16h a 19h30 ![]()

La Comisión Europea publica una nueva edición de la Guia Azul – Blue Guide (la biblia del marcado CE europeo)
La «guía azul» es la referencia de la aplicación del Nuevo Enfoque y el Enfoque Global a directivas y reglamentos de productos (industriales: maquinas, EPIs, electrodomésticos, … incluyendo también a los productos sanitarios) ahora regulado por el nuevo marco legislativo (NML) incluyendo como novedad importante la adopción del reglamento (UE) 2019/1020 de vigilancia del mercado y conformidad de los productos. El NML tiene en cuenta la existencia de todos los operadores económicos en la cadena de suministro (fabricantes, representantes autorizados, distribuidores e importadores) y de sus respectivas funciones en relación con el producto. Ahora el importador tiene unas obligaciones claras en relación con la conformidad de los productos, y cuando un distribuidor o un importador modifica un producto o lo comercializa bajo su propio nombre, se convierte en el equivalente del fabricante y debe asumir las responsabilidades de este en relación con el producto.
Buena lectura … 

Pitch Day @UAM_Madrid de su programa Emprende 13 julio 2022 by @UAM_emprende @Genesis_Biomed
El programa está destinado a impulsar la creación de Spin-Offs basadas en el conocimiento generado por la UAM y sus centros de investigación. Para ello, se cuenta con investigadores punteros que desarrollan soluciones en diferentes áreas de la salud y la medicina. El programa corre a cargo del Vicerrectorado de Transferencia, Innovación y Cultura de la UAM con la colaboración de GENESIS Biomed. Desde Tecno-med hemos tenido el honor de participar como mentores en esta iniciativa que esperamos sea un éxito.
Se contarán los avances que han logrado los investigadores para convertir sus proyectos o líneas de investigación en un modelo de negocio adaptado a las necesidades del mercado. El evento se realiza presencialmente en la UAM, Campus de Cantoblanco, Edificio de Rectorado, C/Einstein 3, 28049 Madrid, Planta5, Sala G, y también se puede asistir de forma online de 16h a 19h30 ![]()
Acto presentación iniciativa española «Avanzar en la regulación de la IA» 27 jun 2022 Bruselas 9h30-13h10 CEST por streaming
El evento tiene como objetivo lanzar el piloto de España para un Sandbox Normativo sobre Inteligencia Artificial (IA). La Inteligencia Artificial es una prioridad para España y para Europa. El sandbox regulatorio pilotado por España tiene como objetivo crear las condiciones para una implementación fluida de las futuras normas regulatorias que se aplican en el campo. El sandbox facilitará la prueba de soluciones técnicas específicas y procedimientos de cumplimiento y, al mismo tiempo, apoyará a las empresas y especialmente a las PYME para evitar incertidumbres y cargas innecesarias. Participan la vicepresidenta Nadia Calviño y la secretaria de estado Carme Artigas.
Se espera que el proceso piloto establezca un marco operativo para todas las organizaciones interesadas y cree sinergias con otras iniciativas nacionales. Se alienta a otros Estados miembros de la UE a unirse o dar seguimiento a iniciativas similares con el objetivo de crear un sistema paneuropeo de sandbox de IA.
Seguiremos informando …

La Comisión Europea publica un informe actualizando la definición nanomaterial
Este informe hace una actualización de la definición de nanomaterial (ponemos aqui una traducción a español):
«Nanomaterial»: material natural, fortuito o fabricado, constituido por partículas sólidas que están presentes, solas o como partículas constituyentes identificables en agregados o aglomerados, y en el que el 50 % o más de estas partículas en la distribución de tamaños basada en el número cumplen al menos una de las siguientes condiciones:
(a) una o más dimensiones externas de la partícula están en el rango de tamaño de 1 nm a 100 nm
(b) la partícula tiene una forma alargada, como una varilla, una fibra o un tubo, en la que dos dimensiones externas son inferiores a 1 nm y la otra dimensión es superior a 100 nm
(c) la partícula tiene forma de placa, en la que una dimensión externa es inferior a 1 nm y las otras dimensiones son superiores a 100 nm.
En la determinación de la distribución de tamaño basada en el número de partículas, no es necesario considerar las partículas con al menos dos dimensiones externas ortogonales mayores de 100 μm.
Sin embargo, un material con una superficie específica por volumen de < 6 m2/cm3 no se considerará un nanomaterial.
Varias publicaciones sobre Inteligencia Artificial aplicada a la sanidad asociado al reglamento de IA

Gran éxito Congreso SEEIC Junio 2022 @SEEIC_spain con todas las novedades de la Ingeniería Clínica española
La SEEIC Sociedad Española de Electromedicina e Ingeniería Clínica celebró con gran exit su congreso anual en el Hotel Melia Avenida de America,
os dejamos aqui algunas fotos …



read more…

Congreso SEEIC del 8-10 Junio 2022 @SEEIC_spain con todas las novedades de la Ingeniería Clínica española
La SEEIC Sociedad Española de Electromedicina e Ingeniería Clínica anuncia para los próximos 8 a 10 de junio la celebración de su congreso anual en el Hotel Melia Avenida de America, donde se presentan todas las novedades de la Ingeniería Clínica después de la pandemia que nos ha mantenido focalizados en ayudar a los profesionales sanitarios.
Este año en formato presencial. Participa Xavier Canals de Tecno-med Ingenieros, vicepresidente de la SEEIC
Nos vemos en Madrid ![]()
read more…
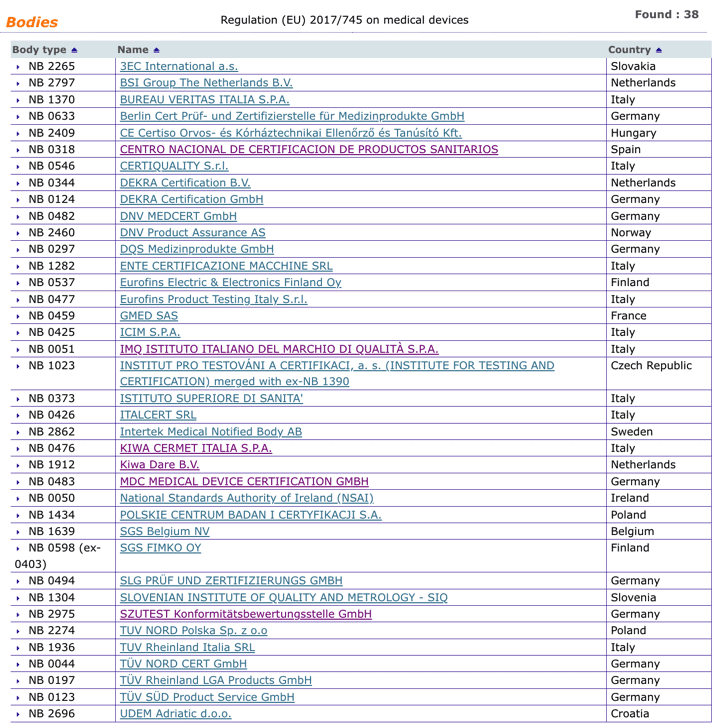
Organismos Notificados MDR (30): Berlin Cert GmbH (Alemania) ON num. 0633 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
Berlin Cert Prüf- und Zertifizierstelle für Medizinprodukte GmbH
Address: Dovestraße 6, 10587 Berlin Alemania
Phone : +49 30 5858 216-0
Email : cert@berlincert.de
Website : http://www.berlincert.de

puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR … read more…

Congreso SEEIC del 8-10 Junio 2022 @SEEIC_spain con todas las novedades de la Ingeniería Clínica española
La SEEIC Sociedad Española de Electromedicina e Ingeniería Clínica anuncia para los próximos 8 a 10 de junio la celebración de su congreso anual en el Hotel Melia Avenida de America, donde se presentan todas las novedades de la Ingeniería Clínica después de la pandemia que nos ha mantenido focalizados en ayudar a los profesionales sanitarios.
Este año en formato presencial. Participa Xavier Canals de Tecno-med Ingenieros, vicepresidente de la SEEIC
Nos vemos en Madrid ![]()
read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

La AEMPS @AEMPSgob abre el proceso de consulta pública para el proyecto de Real Decreto de publicidad de productos sanitarios
Siguiendo el proceso legislativo español la AEMPS inicia el trámite de consulta pública que tiene por objeto recabar la opinión de ciudadanos titulares de derechos e intereses legítimos afectados por un proyecto normativo ya redactado, directamente o a través de las organizaciones o asociaciones que los representen, así como obtener cuantas aportaciones adicionales puedan realizar otras personas o entidades.
Este RD quiere establecer la regulación de la publicidad de los productos sanitarios segregada de la de medicamentos y es una legislación complementaria española al RD 129/2023. Uno de los objetivos es aclarar el articulo 7 de MDR-IVDR relativos a «declaraciones» (claims), es decir, reivindicaciones que pueden inducir a error al profesional o al paciente atribuyéndole funciones o propiedades que no posee.
Esperamos que el legislador de una vuelta de tuerca a los requisitos para facilitar a los agentes económicos la realización de publicidad pero que los charlatanes e «influencers» no se vayan de rositas, como desgraciadamente pasa ahora.
Podemos enviar aportaciones vía mail a normativa.aemps@aemps.es . La fecha de finalización de envío de aportaciones es el próximo 14 de abril de 2023.
Puedes descargártelo en el siguiente hipervinculo:


nueva propuesta de Reglamento Delegado modificando la MDR para el UDI de las lentes de contacto
Como ya había anunciado la Comisión Europea y siguiendo el ejemplo de FDA se establece una codificación especifica para el uni de las lentes de contacto, este es el texto propuesto: read more…
Nuevo ministro de @Sanidadgob : Jose Manuel Miñones @jose_minones – Enhorabuena!!
Damos la bienvenida a un nuevo ministro que es un profesional del sector, licenciado en Farmacia y Doctor por la Universidad de Santiago de Compostela, seguramente podrá dar una vuelta a la sanidad y potenciar la industria española. Esperamos sus próximos pasos, ¿logrará desencallar el RD de publicidad?
Demos los 100 dias de confianza para el cambio.

Publicado por @EU_Health el documento de preguntas y respuestas con respecto al Reglamento 2023/607 de modificación plazos transitorios reglamentos MDR e IVDR
Aqui esta el prometido documento de preguntas y respuestas, después de la publicación el 20 marzo 2023 del Reglamento 2023/607 de modificación de plazos transitorios de MDR e IVDR.
este es el texto del documento del Q&A
este es el texto del reglamento en español

Publicado el nuevo Real Decreto 192/2023 por el que se regulan los productos sanitarios, por @sanidadgob entrando en vigor el 23 de marzo 2023
Hoy se ha publicado el el Real Decreto 192/2023 de productos sanitarios, en el BOE, entrando en vigor según su disposición final cuarta el día siguiente a su publicación, es decir el 23 de marzo de 2023.
este es el texto del RD 192/2023
Publicado por @EU_Health en el DOUE Reglamento 2023/607 de modificación plazos transitorios reglamentos MDR e IVDR. Ya esta en vigor
Os ponemos la foto oficial, en la que, con la firma este 15 de marzo de la presidenta del Parlamento Europeo Roberta Metsola y la ministra Jessika Roswall de la actual presidencia europea sueca en nombre del Consejo Europeo, quedó aprobado el reglamento de modificación de los reglamentos MDR e IVDR.
Publicado el 20 marzo 2023 el Reglamento 2023/607 de modificación de plazos transitorios de MDR e IVDR.
este es el texto del reglamento en español
En breve MDCG publicará un documento de preguntas y respuestas. read more…
Organismos Notificados MDR (38): SZUTEST (Alemania) ON num. 2975 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
SZUTEST Konformitätsbewertungsstelle GmbH
Friedrich-Ebert-Anlage 36 D-60325 Frankfurt am Main – Germany
Phone : +49 69 244 333 026
Email : info@szutest-germany.de
Website : http://www.szutest-germany.de
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR …
lista actualizada IVDR en:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=35
El Mº de Sanidad ( @AEMPSgob ) abre el proceso de audiencia e información pública para el proyecto de Real Decreto por el que se regulan los productos sanitarios para diagnostico in vitro
Siguiendo el proceso legislativo español ahora nos toca el trámite de audiencia en información pública que tiene por objeto recabar la opinión de ciudadanos titulares de derechos e intereses legítimos afectados por un proyecto normativo ya redactado, directamente o a través de las organizaciones o asociaciones que los representen, así como obtener cuantas aportaciones adicionales puedan realizar otras personas o entidades.
Este RD es legislación complementaria española al reglamento MDR (EU) 2017/746 y que debe aclarar, por ejemplo, las licencias sanitarias, los técnicos responsables, ….
Podemos enviar aportaciones vía mail a informacion.publica@sanidad.gob.es . La fecha de finalización de envío de aportaciones es el próximo 3 de abril de 2023.
Puedes descargártelo en el siguiente hipervinculo: