PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2303A – MODIFICACIÓN MDR/IVDR Reglamento 2023/607 EXTENSIÓN PERIODO TRANSITORIO Y ELIMINACION SELLOFF – Como ha quedado?» – 28 ABRIL 2023 12h-14h
El reglamento 2023/607 de modificación de los reglamentos MDR e IVDR en relación a los periodos transitorios para los productos legacy nos abre una nueva ventana temporal que podemos aprovechar para prepararnos mejor para esta adaptación y pensar en «recuperar» algunos productos que habíamos pensado descatalogar.
En esta formación revisamos los nuevos plazos y posibles estrategias.
Fecha: 28 Abril 2023, 12h a 14h en webinar en directo y 10h en teleformación
Esperamos verte ahi … ![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

Jornada «IMPRESIÓN 3D EN EL PUNTO DE ATENCION» by HUGGM 28 oct 2022 – 9h-13h30
No os perdáis esta jornada donde tendremos la presentación de los requisitos reglamentarios de la impresión 3D en hospitales.
Salón de Actos Edificio Materno-Infantil. C/ O’Donnell, 48 – Hospital General Universitario Gregario Marañón
Este es el programa
Podeis inscribiros gratuitamente enviando un mail a 3dlab.hgugm@salud.madrid.org indicando nombre y apellidos, email, teléfono de contacto, centro de procedencia y actividad profesional. (UPAM3D tel.915867083)

Organismos Notificados MDR (33): PCBC (Polonia) ON num. 1434 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
PCBC – POLSKIE CENTRUM BADAN I CERTYFIKACJI S.A.
ul. Pu#awska 469 02-844 Warszawa Poland
Phone : +48 22 464 52 01
Email : pcbc@pcbc.gov.pl
Web : www.pcbc.gov.pl
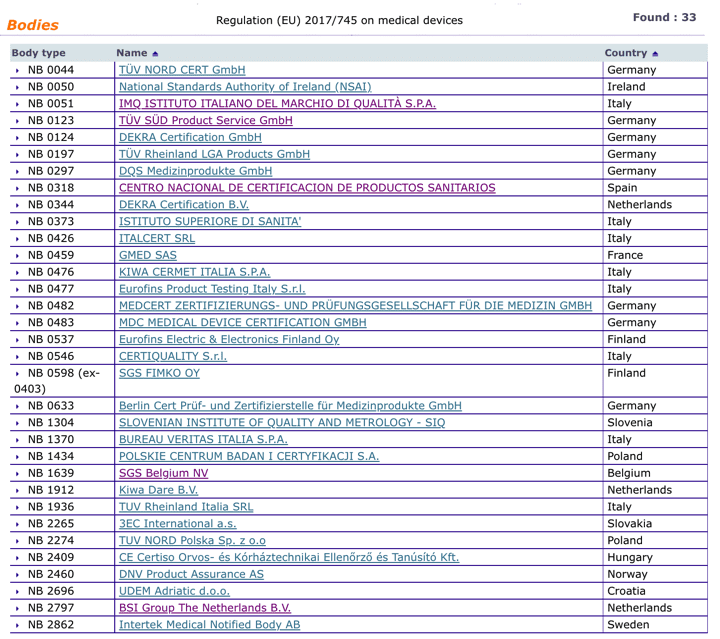
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR read more…

Congreso @CASEIB2022 de la SEIB Sociedad Española Ingenieria Biomedica 23-25’Nov 2022 Valladolid by @SEIB_twit
La SEIB Sociedad Española de Ingeniería Biomédica celebra su Congreso anual https://caseib.es/2022/, después de dos ediciones en las que ha tenido que realizarse de forma virtual debido a la pandemia por COVID-19, de forma totalmente presencial en Valladolid del 23 al 25 de noviembre de 2022. Esta edición del Congreso ha sido organizada por el Grupo de Ingeniería Biomédica (GIB) de la Universidad de Valladolid (UVa) liderado por el profesor Roberto Hornero quien coordina el Grado de Ingeniería Biomédica de la UVa.

Formacion regulatoria productos sanitarios @enginyersbcn 3,10,24 nov y 1 dic, con la colaboración de @tecno_med
Formación sobre los requisitos de los productos sanitarios dirigida a ingenieros. En esta formación, se impartirán en 4 jornadas de 2,5 horas en formato remoto de 17:30h a 20:00h los días 3,10,24 de noviembre y 1 de diciembre de 2022
- Jornada 3/11/2022: Introducción, calificación y clasificación
- Jornada 10/11/2022: Documentación técnica según anexo II y III
- Jornada 24/11/2022: Sistema de calidad según ISO 13485 y MDR/ IVDR
- Jornada 1/12/2022: Licencias y registros. EUDAMED
Impartido por:
Xavier Canals-Riera , Director Tecno-med Ingenieros. Vicepresidente SEEIC. Medical Device Consultant
Claire Murphy , Associate Consultant at Tecno-med Ingenieros.
Plazas limitadas, consigue tu plaza aqui

Formacion gratuita “Como afecta el cambio de regulación a tu producto sanitario?” by @CIMTI_cat con la colaboración de @tecno_med
Para poder comercializar tu producto sanitario en Europa necesitarás obtener el marcado CE, de acuerdo con los reglamentos MDR y IVDR, y cumplir con los reales decretos que establecen los requisitos adicionales en España.
En esta formación, impartida por la consultora especializada Tecno-med, le explicaremos cuáles son los requisitos para poder vender su producto y le explicaremos las últimas novedades y actualizaciones relacionadas con las tres bases del marcado CE:![]()
Organismos Notificados MDR (32): BUREAU VERITAS ITALIA S.P.A (Italia) ON num. 1370 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
BUREAU VERITAS ITALIA S.P.A.
Viale Monza, 347 20126 – MILANO (MI) Italy
Phone : +39 02 270911
Email : info.bv.italia@it.bureauveritas.com
Web: www.bureauveritas.it read more…

Nueva pagina web del Organismo Notificado CNCPS (antes AEMPS) num. 0318 – https://certificaps.gob.es/
CENTRO NACIONAL DE CERTIFICACION DE PRODUCTOS SANITARIOS ON 0318. El CNCps es el Centro Nacional de Certificación de productos sanitarios, una subdirección general adscrita a la Agencia Española de Medicamentos y Productos Sanitarios que tiene como competencias la actuación como Organismo Notificado y la certificación de normas de sistemas de calidad específicas del sector de porductos sanitarios.
Ya puede solicitarse el marcado CE con el ON español CNCPS realizando la solicitud correspondiente a través de la aplicación informática CNCps: https://sinaem.aemps.es/CNCps/Login.aspx En la aplicación se encuentra disponible el manual de usuario.
Leer las instrucciones en la web de CNCPS
Ver lista de tasas del ON 0318:

ULTIMA HORA: Organismo Notificado CNCPS de la @AEMPSgob (España) ON num. 0318 notificado con reglamento MDR, Enhorabuena equipo Gloría Hernández!!!
Por fin!!! Nueva designación del Organismo Notificado español:
CENTRO NACIONAL DE CERTIFICACION DE PRODUCTOS SANITARIOS
Campezo 1. Edificio 7.
Phone : +34 91 822 52 52
Email : on0318@aemps.es
Website : https://www.aemps.gob.es/productos-sanitarios/organismonotificado/
puedes ver la lista siempre actualizada de ON’s en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
Jornada puertas abiertas Area Sanidad Cataluña 29 junio 17h – Auditorio Archivo de la Corona de Aragón
Exito de la jornada de asistencia y de temática. Gran trabajo del Area de Sanidad de Catalunya que no siempre es visible y que esperemos doten de mas medios para las nuevas tareas con los nuevos Reglamentos de Productos Sanitarios.
Os dejamos aqui algunas de las fotos:


Cristina Batlle. Jefa de Area Sanidad Cataluña Susana Andueza. Jefa de Servicio Inspección de Farmacia read more…

Título «Experto Productos Sanitarios» 2022-23 por la @UniBarcelona inicio oct’2022 – abierta matricula
Mejora tu conocimiento y reconocimiento de tu experiencia, en esta formación donde participan reconocidos expertos del sector. Este año también en modalidad online. Puedes ver el programa, pre-inscripcion presencial – pre-inscripción online y cuadro docente
Como cada año colaboramos en: • Electromedicina, IVD e implantables activos. — profesores: Claire Murphy y Xavier Canals
Formación 2017 @Tecno_Sanitaria
Os anunciamos las formaciones presenciales que hemos programado para el próximo año 2017, con sus respectivas fechas, hemos cambiado las de los nuevos reglamentos ya que se retrasa su aprobación.
Pueden realizarse presencialmente en el fecha indicada y online con posterioridad en el portal de formación.
Formación 2017 @Tecno_Sanitaria
 Os anunciamos las formaciones presenciales que hemos programado para el próximo año 2017, con sus respectivas fechas, hemos cambiado las de los nuevos reglamentos ya que se retrasa su aprobación.
Os anunciamos las formaciones presenciales que hemos programado para el próximo año 2017, con sus respectivas fechas, hemos cambiado las de los nuevos reglamentos ya que se retrasa su aprobación.
Pueden realizarse presencialmente en el fecha indicada y online con posterioridad en el portal de formación.
Formacion ‘UNE EN ISO 13485:2016 Calidad Tecnologías Sanitarias’ 6 oct 2016
Reserva la fecha para ponerte al día
Fecha: 6 de Octubre de 2016, de 10h a 18h. Precio: 300 Eur, incluye desayuno, comida, documentación y certificado.
Lugar de celebración: Barcelona, Barcelona Advanced Industry Park. C/Marie Curie n.8 08042 Barcelona [M] L4 Lluchmajor tel. 932917739.
El curso es de 1 jornada la parte presencial e incluye 25 horas adicionales en la web de formación:http://formacion.tecnologias-sanitarias.com/course/view.php?id=39
![]()
Formacion ‘UNE EN ISO 13485:2016 Calidad Tecnologías Sanitarias’ 6 oct 2016
Formación online ‘ACTUALIZACIÓN A LA NUEVA UNE-EN ISO 13485:2016’ 30h a tu ritmo
Prepárate durante el verano para la adaptación a la nueva edición de la norma, puedes cursarlo en nuestro portal de formación (30 horas) en: http://formacion.tecnologias-sanitarias.com/course/view.php?id=40

MDCG: actualización publicacion MDCG 2020-3 rev1 de cambios significativos
Nueva actualización de la publicación del grupo de coordinación de productos sanitarios. El artículo 120, apartado 3, del Reglamento (UE) 2017/745 sobre productos sanitarios (MDR), modificado en último lugar por el Reglamento (UE) 2023/607, establece que los productos que sigan cumpliendo la AIMDD o la MDD podrán comercializarse o ponerse en servicio hasta el 31 de diciembre de 20271 o el 31 de diciembre de 20282, según proceda, siempre que se cumplan las condiciones establecidas en el artículo 120, apartado 3 quater, del MDR. Estos productos se denominan «productos legacy» y, en consonancia con el MDCG 2021-25, por «productos legacy» debe entenderse los productos que, de conformidad con las disposiciones transitorias del MDR, se comercializan después de la fecha de aplicación del MDR (es decir, el 26 de mayo de 2021) si se cumplen determinadas condiciones. Es pues importante esta guía para que los fabricantes y los organismos notificados tengan claro qué cambios en el diseño o la finalidad prevista se considerarían «significativos».

Newsletter @EU_Health «MEDICAL DEVICES NEWS» Mayo 2023
Nuevo SR (standarization request) M592 para la actualización de la lista de normas armonizadas para ecodiseño

La Comisión Europea publica una nueva actualización de la propuesta de reglamento para la Inteligencia Artificial que incluye software médico

Boletin @AEMPSgob 1T 2023 de productos sanitarios

Publicado en DOUE las Orientaciones de la Comisión relativas al contenido y la estructura del resumen del informe de la investigación clínica según art. 77.5 MDR
El artículo 77, apartado 5, del Reglamento MDR, establece que el promotor de una investigación clínica con productos sanitarios presentará un informe en el plazo de un año a partir de la finalización de la investigación clínica o en un plazo de tres meses a partir de su finalización anticipada, y dicho informe irá acompañado de un resumen. Los requisitos mínimos del informe de la investigación clínica se exponen en la sección 7 del capítulo III del anexo XV del Reglamento y estas directrices lo detallan.

Publicado por @EU_Health el borrador de la modificación de MDR para los productos de Anexo XVI

La AEMPS @AEMPSgob actualiza la lista de implantes de relleno y avisa sobre la aplicación de MDR lista Anexo XVI
La AEMPS clarifica además los distintos tipos de productos usados en el campo estético y la aplicación de MDR y RD 192/20223:








