PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2304 – REGLAMENTOS MDR/IVDR y Real Decreto P.S. a 1 y 2 años de su fecha de Aplicación» – 26 MAYO 2023
El 26 de mayo 2021 y 2023 son las fechas de aplicación de los nuevos Reglamentos MDR e IVDR respectivamente. En esta ocasión, realizaremos 2 sesiones de formación – una para MDR y otra para IVDR – para revisar el estado actual de cada reglamento, así como todas las novedades focalizando en el impacto de estos cambios en los distintos agentes económicos y usuarios.
Fecha: 26 Mayo 2023, 9h a 14h30 en webinar en directo y 25h en teleformación
Esperamos verte ahi … ![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

Organismos Notificados MDR (35): NB 1023 INSTITUT PRO TESTOVÁNI A CERTIFIKACI (República Checa) ON num. 1023 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
INSTITUT PRO TESTOVÁNI A CERTIFIKACI, a. s. (INSTITUTE FOR TESTING AND CERTIFICATION) merged with ex-NB 1390
trida Tomase Bati 299, Louky, 76302 ZLIN, Czech Republic
Phone : +420-572 779 912
Email : director@itczlin.cz
Website : www.itczlin.cz
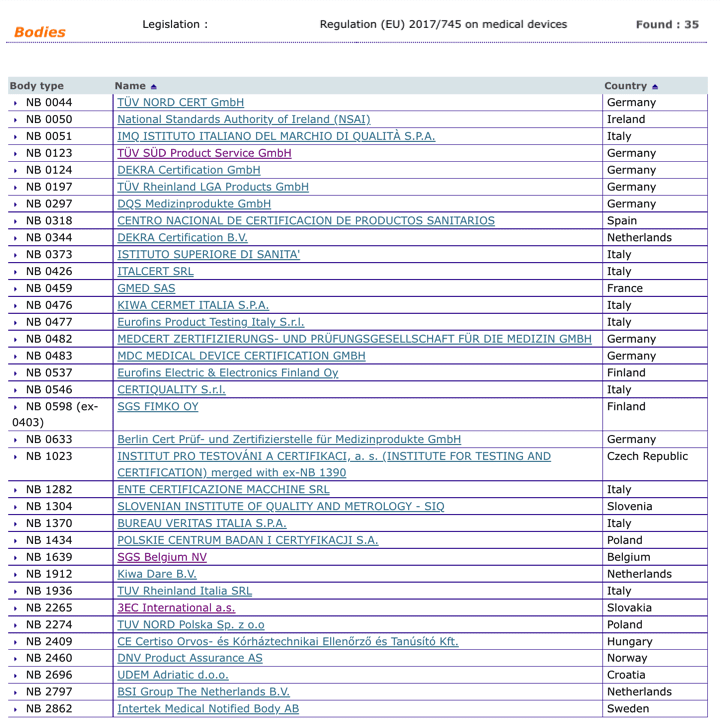
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR … read more…

Congreso @CASEIB2022 de la SEIB Sociedad Española Ingenieria Biomedica 23-25’Nov 2022 Valladolid by @SEIB_twit
La SEIB Sociedad Española de Ingeniería Biomédica celebró su Congreso anual https://caseib.es/2022/, en Valladolid del 23 al 25 de noviembre de 2022. Esta edición del Congreso ha sido organizada por el Grupo de Ingeniería Biomédica (GIB) de la Universidad de Valladolid (UVa) liderado por el profesor Roberto Hornero quien coordina el Grado de Ingeniería Biomédica de la UVa

@NormasUNE anuncia su nueva marca (fíjate incluye un globo de viñeta de comic en la U)
UNE, Asociación Española de Normalización ha creado una nueva identidad visual más actual, relevante y global, que refleja su nuevo propósito y valores y como elementos diferenciador del nuevo logotipo es el símbolo gráfico del diálogo que compone la U y que incluye un “globo” de viñeta de comic como sinónimo de consenso y diálogo.
Otro elemento de esta comunicación estratégica es un nuevo vídeo institucional: “UNE. Progreso Compartido”, que refleja la esencia de la normalización: el diálogo, y cómo UNE, a lo largo de su historia, como organización global, ha generado y compartido conocimiento a través de las normas. Puedes ver aquí el vídeo: https://youtu.be/P0nkMWyMGO4
#MEDICA2022 dia 4 @MEDICAtradefair 14 a 17 Nov 2022 – nos vemos en nuestro stand Hall 15 K03 (stand agrupado @FENIN_es )
#MEDICA2022 dia 3 @MEDICAtradefair 14 a 17 Nov 2022 – nos vemos en nuestro stand Hall 15 K03 (stand agrupado @FENIN_es )
Este tercer día también ok … visitamos a los stands españoles y vemos mucho movimiento … fantástico.
Nos vienen a ver varios Organismos Notificados y Laboratorios de ensayos, gracias por la confianza.
Siguen las charlas en los distintos FORUMs donde se tratan tanto temas IVD, como regulatorios, como Health IT, …
nos vemos en nuestro stand H15/K03 en el stand agrupado de Fenin.
esta es nuestra entrada en el catalogo: https://www.medica-tradefair.com/vis/v1/es/exhibitors/medcom2022.2718279
nos vemos allí …
Jornadas anuales #ITEMAS2022 16-17 nov en @IMIBIC – Cordoba by @itemas con la participación de @tecno_med
La ciudad de Córdoba es este año la sede de las Jornadas Anuales de ITEMAS. El encuentro reunirá, como todos los años, a investigadores y técnicos de innovación de las UAIs de los 18 nodos de ITEMAS y los diferentes centros adheridos. Junto a ellos, estarán presentes representantes de los diferentes agentes del ecosistema innovador. El Instituto de Investigación Biomédica de Córdoba (IMIBIC) será el encargado de organizar estas jornadas que servirán para hacer balance del camino recorrido por ITEMAS en el último año y reflexionar sobre los retos que tiene por delante la Plataforma y el mundo de la innovación en salud en nuestro país. Accede a la web y programa del evento.![]()
Dia Mundial de la Calidad (también ISO 13485) – 10 Nov 2022 @AEC_es @AENOR @BSI_iberia @SGS_spain CNCPS @AEMPSgob @TUV_es @TUVSUD
Jornadas anuales #ITEMAS2022 16-17 nov en @IMIBIC – Cordoba by @itemas con la participación de @tecno_med
La ciudad de Córdoba es este año la sede de las Jornadas Anuales de ITEMAS. El encuentro reunirá, como todos los años, a investigadores y técnicos de innovación de las UAIs de los 18 nodos de ITEMAS y los diferentes centros adheridos. Junto a ellos, estarán presentes representantes de los diferentes agentes del ecosistema innovador. El Instituto de Investigación Biomédica de Córdoba (IMIBIC) será el encargado de organizar estas jornadas que servirán para hacer balance del camino recorrido por ITEMAS en el último año y reflexionar sobre los retos que tiene por delante la Plataforma y el mundo de la innovación en salud en nuestro país. Accede a la web y programa del evento.![]()
Formacion regulatoria productos sanitarios @enginyersbcn 3,10,24 nov y 1 dic, con la colaboración de @tecno_med
Formación sobre los requisitos de los productos sanitarios dirigida a ingenieros. En esta formación, se impartirán en 4 jornadas de 2,5 horas en formato remoto de 17:30h a 20:00h los días 3,10,24 de noviembre y 1 de diciembre de 2022. se imparte en castellano para facilitar la participación de ingenieros de toda España.
- Jornada 3/11/2022: Introducción, calificación y clasificación
- Jornada 10/11/2022: Documentación técnica según anexo II y III
- Jornada 24/11/2022: Sistema de calidad según ISO 13485 y MDR/ IVDR
- Jornada 1/12/2022: Licencias y registros. EUDAMED
Impartido por:
Xavier Canals-Riera , Director Tecno-med Ingenieros. Vicepresidente SEEIC. Medical Device Consultant
Claire Murphy , Associate Consultant at Tecno-med Ingenieros.
Plazas limitadas, consigue tu plaza aqui

CEN y CENELEC @Standards4EU anuncian una presentación el 5’Oct 2022 9h30-12h30 sobre productos EPI-MD de uso dual (por ejemplo algunas mascarillas)
5 Mayo 2017 publicación en el DOUE del nuevo Reglamento (EU) 2017/746 sobre los productos sanitarios para diagnóstico in vitro (IVDR)
REGLAMENTO IVDR (EU) 2017/746 sobre los IVD
Por fin se ha publicado en el DOUE el Reglamento de Productos Sanitarios para diagnóstico in vitro. Su entrada en vigor es a los 20 dias de su publicación (fecha de entrada en vigor 26 mayo 2017) y su fecha de aplicación según el periodo transitorio de 5 años, que se indica en su articulo 113, será en fecha 26 de mayo de 2022.
Estamos preparando unas jornadas de formación que pensamos pueden ser de tu interés:
Barcelona 6 de Julio de 2017 “Nuevo Reglamento IVDR” 
Madrid 13 de Julio de 2017 “Nuevo Reglamento IVDR” 
Valencia 14 de Julio de 2017 “Nuevos Reglamentos MDR + IVDR” 
Bilbao 21 de Julio de 2017 Nuevos Reglamentos MDR + IVDR” 
Esperamos contar con tu presencia. Gracias por tu confianza
Puedes bajarte el texto completo en español aquí:
https://www.tecnologias-sanitarias.com/wp-content/uploads/2016/08/IVDR.pdf
Formacion ‘UNE EN ISO 13485:2016 Calidad Tecnologías Sanitarias’ 1 jun BCN / 2 jun MADRID

1 de Junio 2017, de 10h a 18h – Parque Tecnológico BCN – C/ Marie Curie nº 8 – 08042 Barcelona
2 de Junio 2017, de 10h a 18h – Parque Empresarial Campo de las Naciones – C/ Ribera del Loira nº 46 – 28042 Madrid
Reserva la fecha para ponerte al día e inscríbete:
Formación nuevo Reglamento de Productos Sanitarios (MDR)

Después de que el Parlamento Europeo aprobó el Reglamento de Productos Sanitarios. Ahora solo falta su publicación en el DOUE y entrará en vigor a los 20 días de su publicación (fecha de entrada en vigor prevista junio 2017) y su fecha de aplicación según el periodo transitorio de 3 años, que se indica en su articulo 123, será el año 2020.
Estamos preparando unas jornadas de formación que pensamos pueden ser de tu interés:
Barcelona 5 de Julio “Nuevo Reglamento MDR” 
Madrid 12 de Julio “Nuevo Reglamento MDR” 
Valencia 14 de Julio “Nuevos Reglamentos MDR + IVDR” 
Bilbao 21 de Julio «Nuevos Reglamentos MDR + IVDR” 
Esperamos contar con tu presencia. Gracias por tu confianza
Formación nuevo Reglamento de Productos Sanitarios para diagnóstico in vitro (IVDR)

Después de que el Parlamento Europeo aprobó el Reglamento de Productos Sanitarios. Ahora solo falta su publicación en el DOUE y entrará en vigor a los 20 días de su publicación (fecha de entrada en vigor prevista junio 2017) y su fecha de aplicación según el periodo transitorio de 5 años, que se indica en su articulo 113, será el año 2022.
Estamos preparando unas jornadas de formación que pensamos pueden ser de tu interés:
Barcelona 6 de Julio “Nuevo Reglamento IVDR” 
Madrid 13 de Julio “Nuevo Reglamento IVDR” 
Valencia 14 de Julio “Nuevos Reglamentos MDR + IVDR” 
Bilbao 21 de Julio «Nuevos Reglamentos MDR + IVDR” 
Esperamos contar con tu presencia. Gracias por tu confianza read more…
Jornada formacion @Tecno_Sanitaria “Evaluación Clinica de Productos Sanitarios y PMCF” 23 Marzo Barcelona
Formación “Normas y ensayos EMC” Grupo Compatibilidad Electromagnética GCEM 6 a 9 Marzo 2017
Nuestros colegas de la UPC preparan una formación sobre EMC que pensamos puede ser de interés para fabricantes de equipos electromédicos y para instaladores que quieran adquirir unos conocimientos de la base de estas medidas
ULTIMAS PLAZAS: Jornada formación @Tecno_Sanitaria “Postmarket Surveillance PMS” 2 Feb 2017
Jornada de formación de uno de los cambios mas relevantes asociados al nuevo Reglamento pero que ya nos pide el Organismo Notificado asociado a la nueva MEDDEV 2.7/1.![]()
Ven a esta jornada y encontrarás estrategias para integrar toda la información del mercado en nuestro sistema de gestión de la calidad y documentación técnica de una familia de productos sanitarios. read more…
Evaluación Clínica según MEDDEV 2.7/1 – 2016 ya exigida por los Organismos Notificados

La nueva guia MEDDEV 2.7/1 incluye cambios relevantes en la realización de la evaluación clínica de un producto sanitario y ya nos los piden los Organismos Notificados habiéndose dado ya el caso de suspender y anular el certificado a la organización que no se ha puesto al día. Os presentamos una guia de los principales cambios elaborada por nuestra organización
podeis consultarla aqui:
http://www.pharmatech.es/articulos/20170109/guia-meddev-2-7-1-rev-4-guia-evaluacion-clinica#.WHlxS7bhCAw
Aunque la base es la misma esta nueva edición nos orienta para trabajar con productos sin equivalente o estándar en el mercado y por tanto con pocos o ningún resultado en las búsquedas de bibliografía de equivalentes, también establece la posibilidad de realizar la revisión de esta evaluación hasta cada 5 años si el producto no es de alto riesgo read more…
Jornada formación @Tecno_Sanitaria “Postmarket Surveillance PMS” 2 Feb 2017
Jornada de formación de uno de los cambios mas relevantes asociados al nuevo Reglamento pero que ya nos pide el Organismo Notificado asociado a la nueva MEDDEV 2.7/1.![]() read more…
read more…
Formacion @SGS_cbe_spain sobre Technical File de un producto sanitario 24-25 Enero
Con la participación de expertos revisores del Organismo Notificado en Madrid los próximos 24 y 25 de enero read more…
Abierta 12 nuevas convocatorias EU4Health 2023 para proyectos de salud incluyendo una call especifica para productos sanitarios huérfanos

EUDAMED playground publica una nueva actualización v 3.4.0 (Mayo 2023)

Publicado Reglamento 2023/1194 que extiende los plazos de fin de periodos transitorios pero continua la cuenta atrás para la entrada en aplicación MDR y RD 192/2023 para el próximo 22 de junio 2023
Se aprueba la modificación de las especificaciones comunes extendiendo los plazos transitorios pero no se modifica la fecha de aplicación.
El próximo 22 de junio entra en aplicación el reglamento MDR y el RD 192/2023 a los productos de la lista de anexo XVI
Os ofrecemos nuestro servicio de:
para analizar vuestro caso y proponeros un plan de actuación. 
El Parlamento Europeo aprueba en la sesión del 14 de junio la primera lectura del acta de Inteligencia Artificial
Nueva guía de FDA para los 510k de software medico @FDAdeviceInfo
FDA introduce el concepto «función de software del producto», cuya definición es:
Función de software del producto: función de software que cumple con la definición de producto en la sección 201 (h) de la Ley FD&C. “Software como dispositivo médico (SaMD)” y “Software en un dispositivo médico (SiMD)” son funciones de software del dispositivo.
Por ejemplo, la función de software de un dispositivo puede controlar un dispositivo de hardware o ser parte de un dispositivo de hardware (es decir, Software en un dispositivo médico, o SiMD) o ser un dispositivo sin ser parte de un dispositivo de hardware (es decir, Software como un dispositivo médico o SaMD).
Para cualquier producto dado, el término «función» es un propósito distinto del producto, que podría ser el uso previsto o un subconjunto del uso previsto del producto.

Finalizó el 26 de mayo el plazo para la inclusión en el etiquetado del UDI para productos sanitarios MDR de clases IIa y IIb
Los plazos establecidos por el Reglamento de MDR para la inclusión del UDI en el etiquetado son los 26 de mayo de los años:
Es decir que desde el 26 de mayo 2023 pasado deben incluir el UDI los productos sanitarios de la clase III, clase IIb y clase IIa certificados con MDR.
y desde 26 de mayo de 2023 debe incluir UDI los productos sanitarios para diagnostico in vitro clase D certificados con IVDR
Deberemos actualizar nuestras comunicaciones en CCPS de AEMPS con estos nuevos etiquetados.

#SEDE publica la «Guía de reprocesado de dispositivos médicos y quirúrgicos» presentada en sus 1ª Jornadas Nacionales en Valencia
La Sociedad Española de Desinfección y Esterilización (SEDE) celebró sus primeras jornadas en Valencia el 24 y 25 de mayo 2023 y en ella el experto Juan José Criado Álvarez realizó la presentación de la «guía de reprocesado de dispositivos médicos y quirúrgicos 2023» del que es uno de los autores, aunque por problemas editoriales aun no se pudo entregar a los asistentes
Juan José mantiene el blog «EL AUTOCLAVE» https://elautoclave.wordpress.com/ que es la referencia para las centrales de esterilización de los hospitales españoles

La Comisión Europea publica el modelo de «Confirmation Letter» necesaria para poder aplicar los periodos transitorios extendidos del reglamento 2023/607

El Organismo Notificado español CNCps ya emite la carta de confirmación («Confirmation Letter») a los fabricantes de producto legacy certificados por este para poder aplicar los periodos transitorios extendidos del reglamento 2023/607
Los fabricantes que hayan firmado el acuerdo con el CNCps para la certificación de los productos sanitarios de acuerdo al MDR, si lo desean, podrán solicitar la carta de confirmación a través de la aplicación dentro de la web del CNCps sin que aplique ningún coste de emisión.
La solicitud se realiza seleccionando:
– “Seguimiento CE de productos sanitarios (MDD y IVDD)”
– “Seguimiento post-certificación”
– “Extensión de Certificado CE (Reg. 2023/607)” en la aplicación CNCps.
En la solicitud se deberá aportar el formulario DEX_03 “Solicitud de carta de confirmación Reglamento (UE) 2023/607” y el acuerdo existente firmado por parte del fabricante y por el CNCps (R_DEX_02 y/o R_DEX_22). El acuerdo firmado por parte del CNCps se proporciona una vez se han seguido los pasos establecidos en el folleto informativo R_DEX_01 “Información y condiciones”.
La carta de confirmación elaborada por el CNCps se ajustará a un modelo armonizado y contendrá la identificación inequívoca de los productos para los cuales el fabricante ha solicitado la certificación bajo MDR, que son los que se beneficiarán de los periodos transitorios extendidos.