PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2405 – IMPORTADORES Y DISTRIBUIDORES DE PROD.SANIT. según REQUISITOS MDR / IVDR y RD» – 18 Abr 2024 9h-14h
Los reglamentos MDR/IVDR y nuevo Real Decreto 192/2023 (RD IVD en borrador) refuerzan los requisitos a los importadores y distribuidores involucrados en el suministro, instalación, formación y mantenimiento de productos sanitarios. En esta formación, revisaremos las obligaciones de los importadores y distribuidores así como el impacto de los requisitos reglamentarios en toda la cadena de suministro. Tenemos la posibilidad de realizar mas actividades antes consideradas exclusivas de fabricante como reembalado y traducción de IFU según art.16 pero con requisito de sistema de calidad ISO 13485 certificado, también el registro del UDI-DI, el nuevo Registro de Comercialización de la AEMPS, …
No te pierdas esta jornada donde contaremos las novedades relativas a estas actividades según los nuevos reglamentos
Fecha: 18 Abril 2024, 9h a 14h en webinar en directo y 25h en teleformación
Esperamos verte ahi … ![]()
@RSNA 2018 abre sus puertas: USA Chicago #RSNA18 del 25 a 30 Nov
Exito de la MEDICA 2018 @MEDICAtradefair 12 a 15 Nov – GRACIAS por venir a saludarnos al stand H15/F21 de @Tecno_med
Exito de la MEDICA 2018 @MEDICAtradefair 12 a 15 Nov – la feria de la Tecnologia Sanitaria con stand H15/F21 de @Tecno_med
 Como cada año hemos acudido a la cita de MEDICA: 19 pabellones llenos más de 6000 expositores (140 españoles, el año pasado 123).
Como cada año hemos acudido a la cita de MEDICA: 19 pabellones llenos más de 6000 expositores (140 españoles, el año pasado 123).
este año con stand propio en Hall 15 / F21 (con FENIN), muchas gracias a todos los que nos habéis venido a saludar.
visita la pagina web de las empresas españolas: http://spanishcompanies-medica.com/
esta es la nuestra: http://spanishcompanies-medica.com/company/tecno-med-ingenieros/


Magnifica presentación de Maria Alaez Directora Técnica de FENIN sobre el estado del Reglamento cuando ya ha transcurrido la mitad del periodo de adaptación.


En el stand, nos hacemos una foto con la Secretaria General de FENIN Margarita Alfonsel.

HASTA EL AÑO PRÓXIMO …
MEDICA 2018 @MEDICAtradefair 12 a 15 Nov – la feria del sector de tecnologia sanitaria con stand H15/F12 de @Tecno_med
Viento en popa … 19 pabellones llenos más de 6000 expositores (140 españoles, el año pasado 123). No te lo pierdas …
y este año tenemos stand Hall 15 / F12 (con FENIN) te esperamos allí, y si tu también tienes stand vendremos como cada año a saludarte.
CPhl Worldwide @cphiww 9-11 Octubre 2018 Madrid
La feria líder dentro del sector farmacéutico, CPhI Worldwide, celebrará su próxima edición en Madrid del 9 al 11 de octubre de 2018, Madrid acogerá la feria de referencia mundial para las empresas farmacéuticas. En el recinto de IFEMA se esperan recibir cerca de 45000 profesionales con mas de 2.500 stands de 153 países.
Este evento organizado por UBM EMEA, servirá como medio para la presentar los avances relevantes en materia de la industria farmacéutica y química. Se realizarán mas de 150 seminarios y charlas informativas gratuitas sobre los diferentes sectores involucrados en esta feria.
Mas información en: http://www.cphi.com/europe/
MEDLAB Europe 2 a 4 Octubre 2018 Barcelona @MedlabSeries
La edición de lanzamiento de MEDLAB Europe en Barcelona del 2017 presentó 72 compañías mostrando las últimas tecnologías de vanguardia disponibles en la industria, así como recientes desarrollos de laboratorio médico a mas de 1200 visitantes.
MEDLAB Europa atrajo a más de 1.150 visitantes y delegados durante los 3 días, colocando firmemente el evento como un must-attend para la industria de laboratorios médicos en la región.
MEDLAB Europe acogió 5 conferencias multidisciplinarias acreditadas por CME. Con el apoyo de AEBM Medicina de Laboratorio, BIOCAT, la Federación Española de Empresas de Salud (FENIN) y acreditado por la Unión Europea de Especialistas Médicos (UEMS), el congreso ofreció un multidisciplinar programa que cubre una variedad de temas, incluida la gestión de laboratorio, histopatología, patología, química clínica, hematología y pruebas en el punto de atención (POCT).
Como MEDLAB Europa continúa expandiéndose en la industria de laboratorios médicos de la región, la próxima edición del evento será el lugar perfecto para posicionar su empresa directamente frente a los tomadores de decisiones de la industria.
@ACCE_CE American Association for Clinical Chemistry 29 jul a 2 agost 2018 Chicago participación española by @Fenin_es
La edición en marcha de la AACC en Chicago con 8 expositores españoles de la mano de FENIN read more…
La patronal europea @MedTechEurope ( a la que pertenece @FENIN_es ) manifiesta su preocupación por la implantación de los reglamentos
MedTech Europe pide a la Comisión Europea, al Parlamento Europeo y a todos los estados miembros de la UE que tengan una “discusión urgente de soluciones” para garantizar que las compañías cumplan con los plazos
Feria FIME 2018 – 17 a 19 julio USA @FIMEShow
Formación “Transitioning to the New EU MDR and IVDR: A workshop on real world implementation experiences” by @RAPSorg
En Bruselas y en un hotel delante de la sede de la Comision se celebra esta interesante jornada organizada por la organización RAPS (Regulatory Affairs Profesional Society) en la que participan representantes de MEDTECH (Fenin Europa), Organismos Notificados y expertos de la Comision Europea. read more…

Impresionante Homenaje a Margarita Alfonsel, @FENIN_es, en los #PremiosTecnologíaySalud 2023 – 22 Nov’23 Madrid
Son estos actos que te dejan huella y donde se demuestra que representando a nuestro sector tenemos ademas de grandes profesionales grandes personas con una mezcla de pasión y sabiduría como la de Margarita.
El salón de actos lleno a rebosar con gente de pie al fondo, estaba todo el sector, con lo que todo hacia pensar que no se trataba de sólo los premios de la Fundación Tecnología y Salud. Estaban de la AEMPS con la directora Lamas presidiendo los premios y entre los asistentes los actuales Carmen Ruiz-Villar, Gloria Hernández, Mercedes Suria, … pero también anteriores : Mª Carmen Abad, Carmen Valls, Mª Jesus Cantalapiedra, …; estaban de la industria directores de las grandes y pequeñas empresas españolas que han sido testigos de sus logros; también de los Hospitales, vemos a varios gerentes y directores de tecnología; Asociaciones profesionales: AEFI, SEEIC, …; por supuesto todo el equipo de FENIN con Pablo Crespo tomando el relevo ; y su familia orgullosos de una esposa y madre; orgullo que compartimos todos ls que hemos coincidido con Margarita, que ha liderado este periodo de cambio en la tecnología sanitaria española. Muchos clientes, consultores, amigos todos, y sorpresa entre los premiados también. (me dejo a mucha gente disculpar … )
Subieron a dar su testimonio, de la trayectoria y méritos cosechados, una representación de los «grandes» con los que ha colaborado: Javier Colás, primer presidente de la Fundación; Daniel Carreño, ex presidente de Fenin; la Dra. Carmen Ayuso, jefa de Genética de FJDíaz; Ana Pastor, ex ministra de Sanidad.
Fue un acto muy emotivo donde en varias ocasiones nos tuvimos que frotar los ojos … esperemos que se nos pegue algo de ti … y como dijo Javier Colás «no decimos adiós, ya que el sector te necesita Margarita».

No me olvido de los premiados, ls Fundación tiene siempre un trabajo ímprobo para seleccionar los logros mas representativos

PREMIADOS TyS 2023
Reconocimiento a la innovación y digitalización estratégica al Hospital 12 de Octubre, por la ‘Estrategia 2020-2024: Transforma 12’ Dra. Carmen Martínez de Pancorbo, directora gerente
Una trayectoria al servicio de los pacientes hematológicos galardonada con el “Premio Fenin a la Innovación Tecnológica Sanitaria 2023” al Dr. José Mª Fernández Rañada, jefe del Servicio de Hematología y Hemoterapia del Hospital Quirónsalud Madrid, uno de los líderes y precursores del trasplante de médula ósea.
Mejorar la vida de las personas con Síndrome de Phelan-McDermid Premio a la «Mejor Organización de Apoyo al Paciente 2023” ha recaído en la Asociación del Síndrome de Phelan-McDermid Norma Alhambra, presidenta.
Educación sanitaria en enfermedad grave Premio al «mejor programa de Educación y Prevención Impulsado por una Comunidad Autónoma 2023” a la “Escuela de Salud y Cuidados” de la Consejería de Salud de Castilla-La Mancha recoge el premio María Teresa Marín, directora general de Humanización y Atención Sociosanitaria
Personalizar la atención en diabetes Premio a la «Mejor Innovación Tecnológica en Salud Impulsada por una Comunidad Autónoma» a la “Unidad de Excelencia en Diabetes”, Hospital Sant Joan de Déu BCN y el Parc Taulí Sabadell, recoge el premio Dr. Roque Cardona, jefe de la Unidad de Diabetes en el HSJD.
Tecnología para abordar las enfermedades neurológicas Premio «Fenin al Emprendimiento en Tecnología Sanitaria 2023” a Bitbrain, por la utilización de una innovadora herramienta para detectar y diagnosticar las enfermedades neurológicas de forma precoz María López Valdés, CEO de Bitbrain.
Algunas fotos …

Encuesta de @AEMPSgob sobre la comunicación de la AEMPS
La AEMPS en su portal nos propone la participación en una encuesta de comunicación para la mejora. Enhorabuena y gracias por esta iniciativa.
participad en la encuesta para mejorar la comunicación …
Yo ya la respondí y puse como mejora la comunicación a los profesionales sanitarios que desconocen la legislación de productos sanitarios …![]()

@RSNA 2023: USA Chicago #RSNA23 del 26-30 Nov
La mayor feria de imagen médica abre como cada años sus puertas en Chicago. Mucha suerte a los participantes!!!
Esta es la web: https://www.rsna.org/Annual-Meeting
seguiremos informando …

Jornada UDI online por @AECOC_es 24 Nov 2023 – 10h a 13h30 con la participación de @AEMPSgob , @FENIN_es y @tecno_med
Formación online organizada por Manel Martinez de AECOC sobre UDI para productos sanitarios, con la participación de Maria Aláez Directora Técnica de FENIN, Xavier Canals de Tecno-med Ingenieros y Pablo Soriano del Organismo Notificado 0318 CNCps presentando las novedades y lecciones aprendidas en la inclusión del UDI en los productos sanitarios bajo MDR e IVDR.![]()
nos vemos en esta formación
read more…

Encuesta de las partes interesadas de ISO 13485 hasta 31 Dic 2023 @NormasUNE @IECstandards @ISOstandards @ITU @MarioGabrielliC
El Comité ISO/TC 210 responsable de la revisión de la norma ISO 13485:2016, ha desarrollado una encuesta para la comunidad de productos sanitarios sobre la norma. La intención de esta encuesta es recopilar comentarios de las partes interesadas sobre el uso existente del estándar con fines regulatorios.
El Comité Técnico 210/Grupo de Trabajo 1 de ISO (ISO/TC 210/WG 1) es responsable del desarrollo de la norma ISO 13485 y al desarrollar la versión 2016, decidió no alinearse completamente con el formato ISO Harmonized Approach to Management System Standards (HAMSS) (a veces denominado Estructura de Alto Nivel – HLS) y el texto obligatorio debido al impacto que esos cambios habrían tenido en los modelos regulatorios a nivel mundial. read more…

INFORS@LUD by @SEISeSalud 12 a 14 Marzo 2024
Nueva edición del Congreso Nacional de Informática de la Salud de la SEIS que con el lema «La cooperación clave para el éxito de la transformación digital del SNS» se celebra en Madrid del 12 al 14 de marzo de 2024
Nos vemos allí … ![]()
INFORSALUD es una cita imprescindible para todos los interesados en el sector de las TIC en Salud y en su contribución a la transformación sanitaria para la mejora de la calidad y a la eficiencia de los sistemas sanitarios.

Exito curso de la Asociación de Buenas Practicas en Seguridad de Pacientes @ABPSegPac «SEGURIDAD Y OPTIMIZACIÓN DE PROCESOS EN LA RUMED HOSPITALARIA» 26, 27 y 28 Oct’2023 Oviedo con la participación de @Tecno_med
Magnifico curso bajo la dirección de Jorge de la Vega, Supervisor Servicio Esterilización Área IV SESPA y Carmen Martínez Ortega, Responsable Medicina Preventiva y SP del Área VIII SESPA; organizado por el Servicio de Esterilización Area IV SESPA y la Asociación de Buenas Practicas en Seguridad de Pacientes en Oviedo del 26 al 28 de Oct’2023 con el objetivo de capacitar a los participantes a comprender los principales factores a tener en cuenta para un proceso seguro en las RUMED y proporcionar una metodología y herramientas para realizar un análisis del circuito del instrumental quirúrgico y lograr un flujo de trabajo estructurado y eficiente cumpliendo los nuevos requisitos del reglamento y RD de productos sanitarios.
Participamos en. la mesa: 26 Oct 16h50 – RD 192/2023. Nuevas oportunidades, nuevos requisitos Claire Murphy y Xavier Canals – Tecno-med Ingenieros Consultores Tecnologías Sanitarias
os dejamos algunas fotos …

Reserva estas fechas: Congreso SEEIC del 5-7 Junio 2024 «La tecnología al servicio del paciente» @SEEIC_spain con todas las novedades de la Ingeniería Clínica española
La SEEIC Sociedad Española de Electromedicina e Ingeniería Clínica anuncia para los próximos 5 a 7 de junio de 2024 la celebración de su congreso, donde se presentan todas las novedades de la Ingeniería Clínica.
Seguiremos informando https://seeic.org/index.php/congresos/nacionales

Dia Mundial de la Ingenieria Clinica #GlobalCEDay2023 21’Oct 2023 @SEEIC_Spain @SEIB_twit @SEISeSalud @AEIHorg @CEDifmbe @AAMI_connect @WHO

El Día Mundial de la Ingenieria Clínica (CE – Clinical Engineering) es una celebración mundial que reconoce la importante contribución de los ingenieros clínicos a la mejora de la salud y el bienestar de la población mundial. Se celebra anualmente el 21 de octubre. La SEEIC participa activamente en este evento.

@WFHSScongress inicia el Congreso mundial esterilización Bruselas 18-21 Oct 2023
Congreso mundial en Bruselas del 18 al 21 de Octubre de 2023 https://www.wfhss-congress.com/
Este año si incluye reprocesado de productos sanitarios de un solo uso y como no IA, ponemos aqui las ponencias que nos llaman la atención:
19 Oct
08.45 – 09.30 CONFERENCE 1 Artificial Intelligence in the Medical world
10.00 – 10.30 CONFERENCE 3 Safety, cost and environmental effects of reprocessing single use medical devices: systematic review and meta-analysis Niam Mcgrath
20 Oct
09.00 – 09.30 CONFERENCE 12 Hospital Sterilization of 3D Printed Devices Randal Eveland (United States)
11.45 – 12.15 CONFERENCE 16 Alignment of global medical device standards and their acceptability for regulatory purposes Richard Bancroft (United Kingdom)
14.30 – 15.00 CONFERENCE 19 Surgical Instrument traceability in sterilization: legal obligation or necessity? Olivier Willième (Belgium)
![]()
Formación «2102 – Gestión de Riesgos según MDR/IVDR y EN ISO 14971» 16 Marzo 2021 9h-14h
Fecha: 16 Marzo 2021, 9h a 14h en webinar en directo y 25h en teleformacion
La gestión de riesgos es una herramienta fundamental en el diseño y la fabricación de los productos sanitarios siendo de aplicación la norma EN ISO 14971:2019. Además, los nuevos reglamentos MDR e IVDR nos obligan a mantener un sistema que contemple todo el ciclo de vida (incluyendo subcontratistas) y la revisión continua de los riesgos en base al PMS y PMC(P)F. En esta formación, conoceremos los detalles de la aplicación de estas normas con los nuevos reglamentos.
![]()
Formación «2101 – UDI y EUDAMED» 26 Enero 2021
Fecha: 26 Enero 2021, 9h a 14h en directo y 25h en teleformacion
Los nuevos reglamentos de productos sanitarios requieren del UDI en el etiquetado de los productos. Los plazos aplicables dependen de la clasificación del producto. No obstante precisaremos también el UDI-Básico para las declaraciones de conformidad, ciertos certificados CE y para el registro de los productos. Como fabricantes, pero también, como importadores, distribuidores y usuarios precisaremos conocer estos requisitos para registrarnos como actores en EUDAMED o consultar su contenido.
Esta es una formación desde el punto de vista regulatorio, te recomendamos que hagas una formación con GS1 Spain (AECOC http://www.aecoc.es) para la parte técnica.
Formación «2101 – UDI y EUDAMED» 26 Enero 2021
Fecha: 26 Enero 2021, 9h a 14h en directo y 25h en teleformacion
Los nuevos reglamentos de productos sanitarios requieren del UDI en el etiquetado de los productos. Los plazos aplicables dependen de la clasificación del producto. No obstante precisaremos también el UDI-Básico para las declaraciones de conformidad, ciertos certificados CE y para el registro de los productos. Como fabricantes, pero también, como importadores, distribuidores y usuarios precisaremos conocer estos requisitos para registrarnos como actores en EUDAMED o consultar su contenido.
Esta es una formación desde el punto de vista regulatorio, te recomendamos que hagas una formación con GS1 Spain (AECOC http://www.aecoc.es) para la parte técnica.
Calendario próximas formaciones @tecno_med
Calendario próximas formaciones @tecno_med
Formación webinar en directo «C2007 MARCADO CE P.SANITARIOS MDR» – 17 DIC 2020 by @tecno_med
Revisaremos los nuevos requisitos para los productos sanitarios según el nuevo reglamento MDR.
17 de Diciembre de 2020, de 9h a 14h en directo y 25h en teleformacion
El curso se desarrolla en dos partes una primera en directo y otra en teleformacion en el portal web https://formacion.tecnologias-sanitarias.com/course/view.php?id=177
Reserva la fecha para ponerte al día e inscríbete
Formación webinar en directo «C2006 MARCADO CE P.SANITARIOS DIAGNÓSTICO IN-VITRO IVDR» – 15 DIC 2020 by @tecno_med
Revisaremos los nuevos requisitos para los productos sanitarios para diagnóstico in vitro según el nuevo reglamento IVDR.
15 de Diciembre de 2020, de 9h a 14h en directo y 25h en teleformacion
El curso se desarrolla en dos partes una primera en directo y otra en teleformacion en el portal web http://formacion.tecnologias-sanitarias.com/course/view.php?id=176
Reserva la fecha para ponerte al día e inscríbete

Formación webinar en directo «C2005 M-HEALTH Y SOFTWARE MEDICO SEGUN MDR» – 3 y 5 Nov 2020 by @tecno_med
Revisaremos los nuevos requisitos para las apps y software médico según los nuevos reglamentos MDR y IVDR.
3 y 5 de Noviembre de 2020, de 9h a 14h en directo y 25h en teleformacion
El curso se desarrolla en dos partes una primera en directo y otra en teleformacion en el portal web http://formacion.tecnologias-sanitarias.com/course/view.php?id=174
Reserva la fecha para ponerte al día e inscríbete
Calendario próximas formaciones @tecno_med
Exito formación «C2004 PRODUCTOS SANITARIOS IN-HOUSE Y A MEDIDA» 15 y 17 sept 2020 by @tecno_med – GRACIAS
Presentación en dos jornadas que nos permitió revisar y debatir con los asistentes los puntos críticos de la regulación de los productos sanitarios fabricados en el hospital para su uso (como por ejemplo el software desarrollado o modificado por el propio hospital, equipos ad hoc, … ) o bien productos fabricados a medida para un paciente determinado. Gracias a todos.
La Comisión Europea publica una nueva actualización del NB Survey de adaptación a MDR/IVDR

@MedtechEurope ( @FENIN_es ) publica el informe «perspective on the final AI Act»

MDCG: publicada nueva MDCG 2024-3 guia contenido CIP Plan de Investigación Clínica

Estado #AIA Artificial Intelligence Act – adoptada en la sesión plenaria del 13 de marzo de 2024 por el Parlamento
El Reglamento, acordado en las negociaciones con los Estados miembros en diciembre de 2023, fue respaldado por la Eurocámara con 523 votos a favor, 46 en contra y 49 abstenciones.
Su objetivo es proteger los derechos fundamentales, la democracia, el Estado de derecho y la sostenibilidad medioambiental frente a la IA que entraña un alto riesgo, impulsando al mismo tiempo la innovación y erigiendo a Europa en líder del sector. El Reglamento fija una serie de obligaciones para la IA en función de sus riesgos potenciales y su nivel de impacto.
Según el articulo 6 se consideran de alto riesgo los sistemas de IA que están cubiertos en la legislación indicada en anexo II (incluye MDR e IVDR)
Próximos pasos
El Reglamento aún está sujeto a una última comprobación jurídica-lingüística. Su aprobación definitiva (mediante el llamado procedimiento de corrección de errores) está prevista para antes del final de la legislatura. La ley también debe ser adoptada formalmente por el Consejo. Entrará en vigor veinte días después de su publicación en el Diario Oficial y será de plena aplicación veinticuatro meses después de su entrada en vigor, con excepción de: las prohibiciones de prácticas (se aplicarán seis meses después de la fecha de entrada en vigor); los códigos de buenas prácticas (nueve meses después); las normas sobre la IA de uso general, incluida la gobernanza (doce meses después), y las obligaciones para los sistemas de alto riesgo (treinta y seis meses después).
Os dejamos aqui el texto en español. Buena lectura
seguiremos informando ..

Nueva publicacion de la FDA para AI MDSW y su tratamiento por sus departamentos @FDAdeviceInfo

Publicada nueva lista de normas armonizadas con IVDR (13) – Decisión de Ejecución (UE) 2024/817
Se actualiza la lista de normas armonizadas ahora tenemos 13 read more…

Publicada nueva lista de normas armonizadas con MDR (25) – Decisión de Ejecución (UE) 2024/815
Se actualiza la lista de normas armonizadas ahora tenemos 25 read more…
Organismos Notificados MDR (44): RISE – Medical Notified Body AB (Suecia) ON num. 3033 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
RISE Medical Notified Body AB
Dirección: Isafjordsgatan 22 / P.O. Box 857
164 40 Kista / SE-501 15 Borås – Sweden
Email : mnb@ri.se
Website : w.ri.se/sv/mnb
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://webgate.ec.europa.eu/single-market-compliance-space/#/notified-bodies/notified-body-list?filter=legislationId:34,bodyTypeId:3,notificationStatusId:1
y para IVDR …
lista actualizada IVDR en:
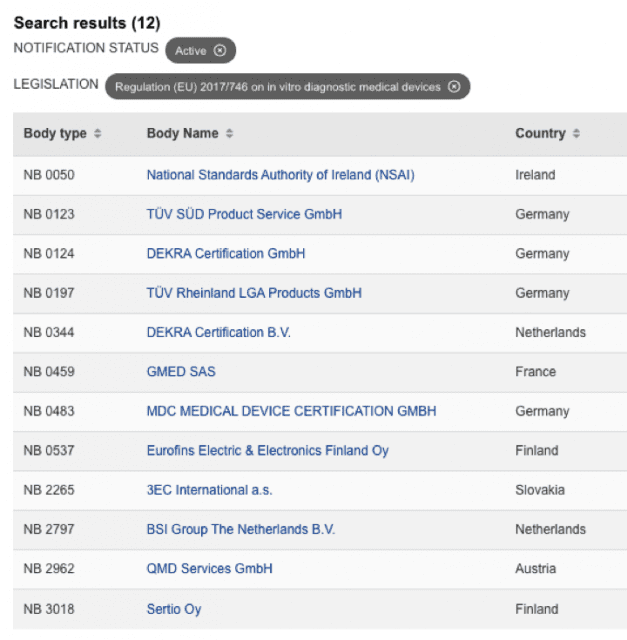
https://webgate.ec.europa.eu/single-market-compliance-space/#/notified-bodies/notified-body-list?filter=legislationId:35,bodyTypeId:3,notificationStatusId:1

ULTIMA HORA: Aprobada por el Consejo Europeo, avanza pues la propuesta de ampliación del periodo transitorio del IVDR y el despliegue gradual de EUDAMED
El Consejo ha respaldado actualizaciones clave de la ley sobre productos sanitarios que ayudarán a prevenir la escasez y facilitarán la transición hacia una mayor transparencia y acceso a la información. El reglamento aprobado el 21 de febrero por los representantes de los Estados miembros de la UE modifica la legislación sobre productos sanitarios, incluidos los productos sanitarios para diagnóstico in vitro (DIV), mediante:
– la ampliación del período de transición para ciertos IVD (particularmente aquellos que son de alto riesgo)
– un despliegue gradual de EUDAMED , la nueva base de datos electrónica europea
– exigir a los fabricantes que señalen la posible escasez de dispositivos médicos críticos y dispositivos IVD
ver nota de prensa ![]()