PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2405 – IMPORTADORES Y DISTRIBUIDORES DE PROD.SANIT. según REQUISITOS MDR / IVDR y RD» – 18 Abr 2024 9h-14h
Ahora que nos acercamos al 26 de mayo de 2024 se vuelven mas relevantes los reglamentos MDR/IVDR y nuevo Real Decreto 192/2023 (RD IVD en borrador) que incrementan los requisitos a los importadores y distribuidores involucrados en el suministro, instalación, formación y mantenimiento de productos sanitarios. Ahora estamos en un periodo transitorio en el que importadores y distribuidores deben revisar el cumplimiento por parte del fabricante de los productos para su introducción en el mercado y liberación por el importador y comercialización por los distribuidores.
En esta formación, revisaremos las obligaciones de los importadores y distribuidores así como el impacto de los requisitos reglamentarios en toda la cadena de suministro. Tenemos la posibilidad de realizar mas actividades antes consideradas exclusivas de fabricante como reembalado y traducción de IFU según art.16 pero con requisito de sistema de calidad ISO 13485 certificado, también el registro del UDI-DI, el nuevo Registro de Comercialización de la AEMPS, …
No te pierdas esta jornada donde contaremos las novedades relativas a estas actividades según los nuevos reglamentos para estos periodos transitorios y como verificar el cumplimiento.
Fecha: 18 Abril 2024, 9h a 14h en webinar en directo y 25h en teleformación
Esperamos verte ahi … ![]()
MEDICA 2019 @MEDICAtradefair 18 a 21 Nov – la feria de la Tecnologia Sanitaria nos vemos en el stand H15 de @FENIN_es
EXPODENTAL 2020 inicia sus preparativos – @ExpoDental_ by @FENIN_es
MEDICA 2019 @MEDICAtradefair 18 a 21 Nov – la feria de la Tecnologia Sanitaria nos vemos en el stand H15 de @FENIN_es
Exito Feria @CosmobeautyBCN 6-8 abril con equipos de medicina estética de anexo XVI que estan regulados por el reglamento de productos sanitarios MDR
@Farmaforum 28 y 29 Marzo 2019
Feria FIME 26 a 28 Junio 2019 @FIMEShow
EXITO de los expositores españoles en Feria @Arab_Health 2019
IDS 2019 – 12 a 16 Marzo Colonia (Alemania) #IDScologne
Con 61 stands españoles (52 en la anterior edición) que representan uno de los sectores mas punteros en productos sanitarios del país, como cada 2 años presentan sus novedades en la feria mas importante del mundo.
Ver la lista de los stands españoles
Feria @Arab_Health 2019 28 a 31 Enero 2019

Como cada año vuelve ArabHealth que se ha consolidado como verdadera competencia de la MEDICA, con 55 expositores de España.

Estos son los expositores españoles: read more…
EXITO @RSNA 2018: USA Chicago #RSNA2018 del 25 a 30 Nov – Quibim, Sedecal, …

#RMD2024 EAAR Annual Conference on MD/IVD Regulatory Compliance Bruselas 26-27 Feb 2024 con la participación de @tecno_med
Ven a estas jornadas donde se abordan los temas mas debatidos de los reglamentos MDR e IVDR por expertos europeos, con la participación de la Comisión Europea, Medtech, EAAR, Qserve, Emergo, Obelis, Axon, Qarad, Informa y Tecno-med.
Claire Murphy presentará en la sesión 2 del 26 de febrero a las 12h30
Nos vemos en Bruselas …
![]()
Felices Navidades !!! os deseamos desde @tecno_med
Jornada @ACCIO_cat online 10 Ene 2024 con la participación de @tecno_med
Jornada organizada por ACCIO para conocer mejor el ecosistema de la bioindustria europea y establecer colaboraciones entre empresas, con ponentes de destacadas organizaciones como Biocat; Veristat (CRO) de medicamentos; Reig Jofre, compañía farmacéutica. La sesión también contará con Xavier Canas, experto clínico del HU Vall d’Hebron, y Claire Murphy, experta especializada en asuntos regulatorios europeos de productos sanitarios.
seguiremos informando
MDCG: actualizada MDCG 2021-27 rev.1 Preguntas y respuestas sobre Articulos 13 y 14 MDR/IVDR
MDCG: actualizada MDCG 2019-07 rev.1 Guia articulo 15 PRCN MDR/IVDR
Encuesta de la Comisión Europea para los fabricantes y EU-REP sobre el estado de implementación de MDR/IVDR hasta 15 enero 2024 – participa !!
La Dirección General de Salud y Seguridad Alimentaria (DG SANTE) de la Comisión Europea encargó un «Estudio de apoyo al seguimiento de la disponibilidad de productos sanitarios en el mercado de la UE» con el objetivo del seguimiento de la disponibilidad de productos sanitarios en el mercado de la UE.
Se ruega a todos los fabricantes y representantes autorizados de productos sanitarios, cuya comercialización esté prevista en los próximos dos años, respondan a la encuesta.
Puedes ver aquí el texto de la encuesta y su convocatoria que como veréis monitoriza el periodo de diciembre de 2022 a diciembre 2025, esta es una etapa.
Difunde esta encuesta para mejorar la aplicación de medidas transitorias al sector … después no nos quejemos !!! ![]()
Además el 7 de diciembre de 2023, 13h-14h hay un webinar del equipo organizador sobre esta encuesta (no es necesario registrarse) donde se puede preguntar
https://us02web.zoom.us/j/85169178337?pwd=Qy94NFZwa2M0VWZpYWxyc0JCK3h3UT09
Identificación de la reunión: 851 6917 8337, código de acceso: 442308
En caso de dudas contacta con FENIN que es la patronal española.
Encuesta de @AEMPSgob a los fabricantes de productos sanitarios IVD. Enhorabuena por esta iniciativa
Encuesta de las partes interesadas de ISO 13485 hasta 31 Dic 2023 @NormasUNE @IECstandards @ISOstandards @ITU
El Comité ISO/TC 210 responsable de la revisión de la norma ISO 13485:2016, ha desarrollado una encuesta para la comunidad de productos sanitarios sobre la norma. La intención de esta encuesta es recopilar comentarios de las partes interesadas sobre el uso existente del estándar con fines regulatorios.
El Comité Técnico 210/Grupo de Trabajo 1 de ISO (ISO/TC 210/WG 1) es responsable del desarrollo de la norma ISO 13485 y al desarrollar la versión 2016, decidió no alinearse completamente con el formato ISO Harmonized Approach to Management System Standards (HAMSS) (a veces denominado Estructura de Alto Nivel – HLS) y el texto obligatorio debido al impacto que esos cambios habrían tenido en los modelos regulatorios a nivel mundial.
El planteamiento del grupo de trabajo ha sido:
1. Mantener la alineación con los requisitos de ISO 9001, en la medida de lo posible, para permitir a las organizaciones operar ambos sistemas de gestión si así lo desean.
2. Partir del texto anterior a HLS donde fuera necesario, para asegurar que la norma fuera adecuada para los propósitos regulatorios globales de productos sanitarios.
3. Incluir las definiciones utilizadas por las autoridades reguladoras mundiales, incluso cuando difieran de las de ISO 9000.
En la actualidad, el formato HAMSS se ha modificado ligeramente y puede permitir cierta flexibilidad adicional en el futuro. Por lo tanto, es importante que ISO/TC 210/WG 1 considere cómo podría aprovecharse el nuevo enfoque manteniendo al mismo tiempo las necesidades de las partes interesadas y la finalidad reguladora de ISO 13485.
El objetivo de esta encuesta es recabar la opinión de las partes interesadas sobre el uso actual de la norma con fines reglamentarios. Con el entorno normativo actual para los productos sanitarios, ISO/TC 210/WG1 necesita evaluar las necesidades de las partes interesadas y determinar los beneficios o impactos negativos de una posible revisión. Además, ISO/TC 210/WG 1 necesita comprender la experiencia de las partes interesadas y evaluar cualquier revisión propuesta con respecto a los modelos normativos mundiales. Si es necesaria una revisión, los datos de la encuesta ayudarán a guiar a ISO/TC 210/WG 1 en la creación de nuevas especificaciones de diseño.
Se espera que completar la encuesta no lleve más de 10-20 minutos. Los participantes tienen la opción de responder sólo a las secciones 1 y 2 si así lo desean. Las tres secciones de la encuesta son las siguientes:
– En la sección 1 se recogen datos demográficos básicos sobre la organización y los participantes,
– en la sección 2 se hacen preguntas sobre el uso del SMS por parte de la organización y el impacto del SMS, y
– La sección 3 proporciona a los participantes un lugar para proporcionar comentarios específicos por cláusula para que ISO/TC 210/WG 1 los tenga en cuenta, en caso de que sea necesaria una revisión de ISO 13485.
participad en la encuesta para mejorar la versión ISO 13485:2024 …
![]()
Este año jugamos al 82304 en la lotería de Navidad !! (ISO 82304 software medico)

Se inicia la @RSNA 2023: USA Chicago #RSNA23 del 26-30 Nov
La mayor feria de imagen médica abre como cada años sus puertas en Chicago. Mucha suerte a los participantes!!!
Esta es la web: https://www.rsna.org/Annual-Meeting
seguiremos informando …

Formación «2107 -EVALUACIÓN CLÍNICA E INVESTIGACIÓN CLÍNICA SEGÚN MDR y EN ISO 14155:2020» – 04 NOV 2021 9h-14h
La evaluación clínica es obligatoria para todos los productos sanitarios. La investigación clínica será prácticamente inevitable para los casos de productos implantables o de Clase III. En esta formación, revisaremos las últimas directrices MDCG y normativa aplicables, incluyendo la EN ISO 14155:2020 Good Clinical Practice, y su aplicación para cumplir las exigencias del Reglamento MDR.![]()

Formación «2108 -MARCADO CE DE PRODUCTOS SANITARIOS – MDR» – 14 DIC 2021 9h-14h
Se ha adoptado y ha entrado en vigor el nuevo Reglamento de Productos Sanitarios MDR. Desde 26/05/2021 se aplica quedando derogada la Directiva 93/42/CEE. En esta formación revisamos todas las novedades focalizando en el impacto de estos cambios en los procedimientos actuales de marcado CE de los productos sanitarios. Así mismo, planteamos los plazos de transición establecidos para la plena aplicación de los requisitos a lo largo de los próximos años.![]()

Formación «2109 -MARCADO CE DE PRODUCTOS SANITARIOS PARA DIAGNOSTICO IN-VITRO – IVDR» – 16 DIC 2021 9h-14h
Se ha adoptado y ha entrado en vigor el nuevo Reglamento de Productos Sanitarios para Diagnóstico In Vitro IVDR. El 26/05/2022 es su fecha de aplicación y se derogará la Directiva 98/79/CE. En esta formación revisamos todas las novedades focalizando en el impacto de estos cambios en los procedimientos actuales de marcado CE de los productos IVD. Así mismo, planteamos los plazos de transición establecidos para la plena aplicación de los requisitos a lo largo de los próximos años..![]()

Calendario próximas formaciones @tecno_med

Formación «2106 – MARCADO CE DE INSTRUMENTACIÓN, SOFTWARE, EQUIPOS AUTODIAGNOSTICO Y NPT SEGÚN IVDR» – 28 Sept 2021 9h-14h
Los instrumentos, aplicaciones software y equipos de autodiagnóstico y NPT para IVD tienen una normativa específica distinta de la de equipos electromédicos y software médico regulados por la MDR (no hay regla 11 para el software). En esta formación, revisaremos todos los requisitos aplicables a esta tipología de productos. Aunque muchos de los instrumentos siguen siendo de autocertificación (Clase A), los instrumentos NPT (Near Patient Testing – “prueba diagnóstica en el lugar de asistencia al paciente”) se clasifican según la determinación que realizan, pasando a precisar la intervención de un Organismo Notificado en muchos casos como los de autodiagnóstico. Revisaremos estos casos de analizadores y los de autodiagnóstico además de las aplicaciones informáticas con consideración de producto sanitario para diagnóstico in vitro.
PROGRAMA
08:30 – Bienvenida: prueba de conexión y recogida de documentación
09:00 Inicio de las presentaciones.
- Intro. IVDR para analizadores y software IVD
- Autodiagnóstico vs Near Patient Testing – POC vs software IVD. Cualificación y clasificación
- Normativa y guías aplicables.
- Documentación Técnica
- Sistema de Calidad
- Licencia y Registros
- Recomendaciones finales. Lecciones aprendidas

Formación «2105 – EN ISO 13485 Y MDR / IVDR ANEXO IX – SISTEMA GESTIÓN CALIDAD PRODUCTOS SANITARIOS» – 15 Junio 2021 9h-14h
Los reglamentos MDR e IVDR de productos sanitarios obligan a todos los agentes económicos a aplicar un sistema de gestión de la calidad actualizando el que ya tienen. Los aspectos que debe abordar este sistema de calidad tienen muchos puntos en común con la normativa EN ISO 13485:2016 pero también algunos aspectos nuevos específicos. En esta formación, focalizaremos en las obligaciones reglamentarias específicas de los reglamentos así como su impacto en los procedimientos documentados y auditorias actuales.
PROGRAMA
08:30 – Bienvenida: prueba de conexión y recogida de documentación
09:00 Inicio de las presentaciones.
- Intro. Estado normativa.
- Gap Analysis UNE EN ISO 13485:2018 vs MDR – IVDR
- Norma UNE EN ISO 13485:2018 – Revisión de requisitos punto a punto
- Auditorias. Auditorias a proveedores cruciales y subcontratistas críticos. Auditorias ON de cert. y sin previo aviso
- Certificación. Cumplimiento Reglamentario
- Recomendaciones finales. Lecciones aprendidas

Curso intensivo «Regulación de productos sanitarios bajo el nuevo reglamento 2017/745» by @FENIN_es inicio 14 mayo 2021 – 15h30-18h con @tecno-med
No os perdáis este curso intensivo organizado por Maria Alaez de FENIN, garantía de calidad.
Participamos en la primera sesión Claire Murphy y Xavier Canals, os contaremos como clasificar productos sanitarios, software médico, de anexo XVI, … según anexo VIII de MDR. 16h15 a 17h.

Formacion «Requisitos marcado CE(MDR), FDA y Gestión Riesgos ISO14971 de equipos y software médico en Neuroeng y Rehab» en el master «Neuroengineering and Rehabilitation» 2021 @UniBarcelona – @la_UPC – @IGuttmann
Este próximo 6 de mayo impartimos la sesión «Requisitos marcado CE(MDR), FDA y Gestión Riesgos ISO14971 de equipos y software médico en Neuroeng y Rehab»
Con la participación de Claire Murphy y Xavier Canals de Tecno-med Ingenieros como parte del equipo de profesores.
mas información: https://www.upc.edu/en/masters/neuroengineering-and-rehabilitation

Formación «2104 – MDR y Real Decreto Productos Sanitarios en fecha aplicación MDR» – 26 Mayo 2021 9h-14h
Fecha: 26 Mayo 2021, 9h a 14h en webinar en directo y 25h en teleformación
En esta formación, conoceremos los detalles de última hora de la aplicación del MDR y la estrategia de operación para los distintos actores
PROGRAMA
08:30 – Bienvenida: prueba de conexión y recogida de documentación
09:00 Inicio de las presentaciones.
1. Introducción. Estado
2. Importador y EU-REP
3. Distribuidor
4. Fabricantes
5. Usuarios (centros sanitarios, farmacias, médicos, pacientes,…)
6. Recomendaciones finales y coloquio.
Coloquio Final
14:00 – Fin de jornada![]()
ver programa detallado
El Reglamento (UE) 2017/745 (MDR) que tiene como fecha de aplicación el próximo 26 de mayo de 2021 se complementa con el nuevo Real Decreto de productos sanitarios derogando en esta fecha a las directivas de 90/385/EC y 93/42/EEC.
En este día tan relevante hacemos esta jornada donde queremos abordar el cambio de un modo práctico haciendo un resumen ejecutivo de estos y revisando que se espera de cada uno de nosotros según el rol que realizamos.
Así revisaremos los requisitos mas relevantes para los fabricantes, los importadores, los distribuidores, los representantes autorizados y los hospitales.
Veremos así las posibles estrategias y oportunidades de mercado de todos los agentes económicos y de los usuarios que van a ser los beneficiarios del cambio y esta adaptación al cambio la queremos sintetizar para vosotros con la filosofía del best-seller de S.Johnson “Quién se ha llevado mi queso”.
Elaboraremos un documento de preguntas y respuestas para el que esperamos vuestras consultas
PROGRAMA
08:30 – Bienvenida: registro y recogida de documentación
09:00 Inicio de las presentaciones.
1. Introducción. Estado
– Legislación actual: MDR y RD.
– Nuevos: productos Lista Anexo XVI, in house, venta -servicio,
– Proceso de Marcado CE: Documentación Técnica + Calidad + Registro/Licencia
– Base de datos europea EUDAMED y bases de datos nacionales
– Adopción, entrada en vigor, aplicación y plazos de transición.
2. Importador y EU-REP
– Novedades y requisitos
– Contratos , mandato.
3. Distribuidor
– Novedades y requisitos
· Traductor
· Re-embalador
· Agrupador
· Almacén
– Contratos
4. Fabricantes
– Novedades y requisitos
– Opciones según clasificación de producto
– Productos legacy
– Marcado CE
– Sistema PMS
- Revisiones anuales: Informe gestión riesgos, PMCF y PSUR
– Sistema de vigilancia – Notificación de incidentes, FSCA / FSN.
5. Usuarios (centros sanitarios, farmacias, médicos, pacientes,…)
– Novedades y requisitos
– Pliegos de prescripciones técnicas
– Fabricación in-house
– Tarjetas implante
– Registro UDI
6. Recomendaciones finales y coloquio.
Coloquio Final
14:00 – Fin de jornada
Plazos

Formación «2103 – Productos sin fin médico de anexo XVI MDR» 21 Abril 2021 9h-14h
Fecha: 21 Abril 2021, 9h a 14h en webinar en directo y 25h en teleformacion
Una novedad del nuevo reglamento MDR es la inclusión de los productos de la lista de anexo XVI de medicina estética tales como los equipos de electroestética de depilación, de liposucción, los implantes de mama y de relleno y las lentes de contacto cosméticas y los equipos de electroestimulación cerebral.
Desafortunadamente aún no tenemos las especificaciones comunes que la MDCG nos acaba de anunciar en su Rolling plan su nuevo retraso al tercer trimestre de 2021 …
En esta formación, conoceremos los detalles de la aplicación del MDR a estos productos y la estrategia de operación.
![]()

MDCG: publicada nueva MDCG 2022-9 rev1 template para SSP IVDR

MDCG: publicada nueva MDCG 2024-5 guidance on content of the Investigator’s Brochure for clinical investigations of medical devices

Publicada la «Guia para la obtención del marcado CE de un software medico según MDR-IVDR» by FISABIO con la colaboración de @tecno_med
La Fundación FISABIO ha publicado esta guia dirigida a los grupos de investigadores, IT de Hospitales y desarrolladores de software médico con consideración de producto sanitario para dar a conocer los requisitos de los nuevos reglamentos de productos sanitarios MDR e IVDR aplicables a dichas aplicaciones informáticas.
Los productos sanitarios, incluyendo los sw médicos, están regulados y para poderse comercializar en Europa deben ostentar el marcado CE de conformidad de acuerdo a los reglamentos MDR e IVDR y cumplir con los reales decretos que establecen los requisitos adicionales en España. La formación va dirigida a proyectos innovadores centrados en el desarrollo de software médico que debe incluir los requisitos regulatorios desde el inicio del mismo para ser un caso de éxito. 

Publicado el Decreto-Lei 29/2024 que deroga la legislación previa e incluye en el orden jurídico de Portugal el reglamento MDR
La Comisión Europea publica un informe sobre el reprocesado de ps de un sólo uso en el dia Internacional de las ciencias de la esterilizacion de productos sanitarios 10 Abril @WFHSS #SEDE
Con la mayoría de países permitiendo este reprocesado de productos de un solo uso aun esta adaptación esta en estado incipiente y pese a los 535000 productos de un solo uso reprocesados en 2022 en Europa, solo se estiman 5 fabricantes europeos y que un 25% de centros sanitarios represará productos sanitarios de un solo uso siendo el motivo principal el económico.
10 de abril dia internacional de las ciencias de la esterilización. Queremos hoy mandar un abrazo y nuestra admiración a todos los profesionales que hacen posible el funcionamiento de las RUMED y CSSD de los hospitales o que trabajan en las empresas fabricantes de equipos de limpieza, desinfección y esterilización.

@COCIR ( @FENIN_es ) publica el position paper alineándose con MEDTECH «Recommendations on the Artificial Intelligence Act (AIA) ‘s alignment with the Medical Devices Regulation (MDR)»
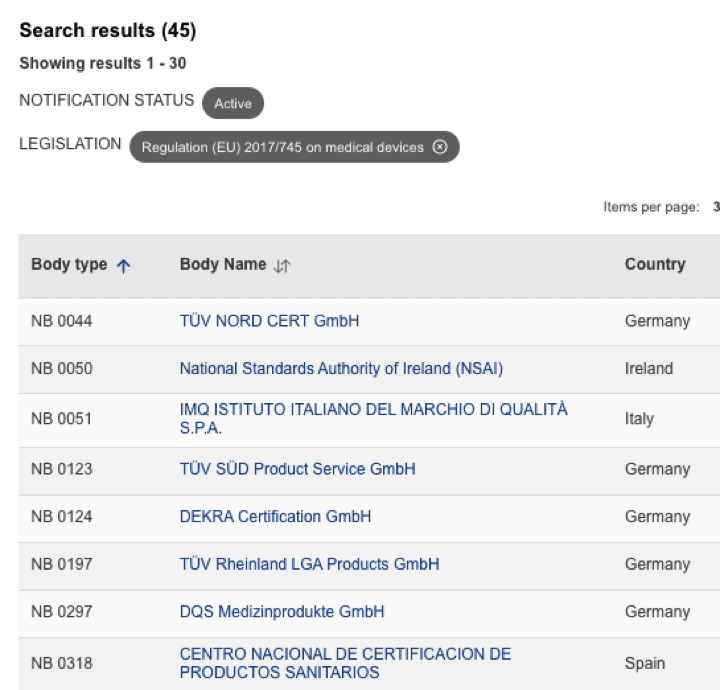
Organismos Notificados MDR (45): TUV SUD DANMARK (Dinamarca) ON num. 2443 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
TÜV SÜD Danmark
Address Strandvejen 125; 2900 Hellerup; Denmark
Email: info.dk@tuvsud.com
Website https://www.tuvsud.com/en-gb/country/denmark
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://webgate.ec.europa.eu/single-market-compliance-space/#/notified-bodies/notified-body-list?filter=legislationId:34,bodyTypeId:3,notificationStatusId:1
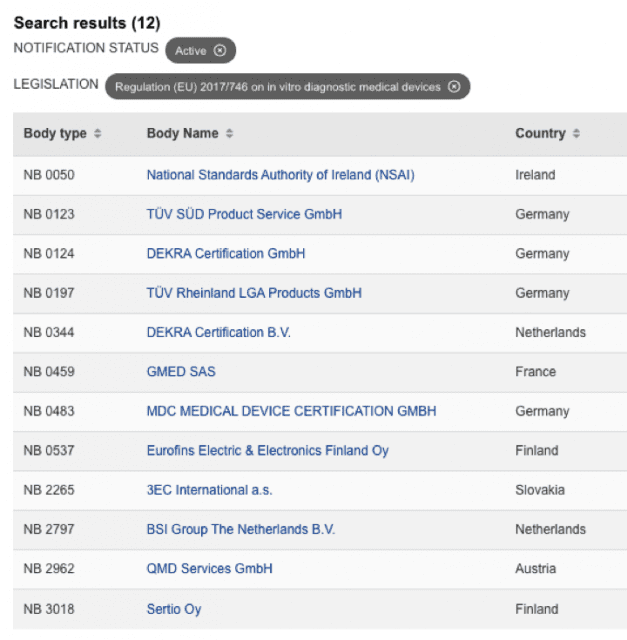
y para IVDR …
lista actualizada IVDR en:
https://webgate.ec.europa.eu/single-market-compliance-space/#/notified-bodies/notified-body-list?filter=legislationId:35,bodyTypeId:3,notificationStatusId:1

Nueva edición de la norma EN ISO 20196:2024 productos sanitarios ivd. Estudios del funcionamiento clínico con muestras de seres humanos – Buenas practicas de estudio
La esperada norma para los estudios de funcionamiento clínico según anexo XIII.2 de IVDR y que es la analoga a la ISO 14155 para producto sanitario general. Descargate la vista preliminar de la misma. Incluye anexo ZA con IVDR referenciando a los requisitos generales de seguridad y funcionamiento que da conformidad: 1, 2, 3, 4, 5, 8, 10, 11, 13, 15, 16, 17, 18 y 19 e incluye el anexo Z
Adhiérete a nuestro contrato de vigilancia tecnológica y estarás al día de las novedades normativas y reglamentarias. No más sorpresas, entérate antes de que sea una no conformidad. https://www.meddev.biz/b2c/producto/WEB105/1/vigilancia-tecnologica-productos-sanitarios

Publicación de @EU_Health Comisión Europea de la revisión 1 de los requisitos relativos al idioma según MDR / IVDR
La Dirección General de Salud y Seguridad Alimentaria (DG SANTE) de la Comisión Europea actualiza las tablas de requisitos de idioma en el etiquetado e instrucciones de uso de productos sanitarios relativos a cada país que puede regularlo según indica MDR e IVDR. Ademas incluye las interfases de usuario para las aplicaciones informáticas.
Descárgatelas aqui TABLA MDR , TABLA IVDR