PRODUCTOS SANITARIOS

.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD

.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2303 -IMPORTADORES Y DISTRIBUIDORES DE PRODUCTOS SANITARIOS según REQUISITOS MDR / IVDR y Real Decreto» 21 Marzo 2023 9h-14h
Los reglamentos MDR/IVDR refuerzan mucho más los requisitos a los agentes económicos involucrados en el suministro, instalación, formación y mantenimiento de productos sanitarios. En esta formación, revisaremos las obligaciones de los importadores y distribuidores así como el impacto de los requisitos reglamentarios en toda la cadena de suministro
fecha: 21 Marzo 2023, 9h a 14h en webinar en directo y 25h en teleformación ![]()
Esperamos verte ahi … read more…
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.
Team-NB publica el «Medical Device Survey» end 2021

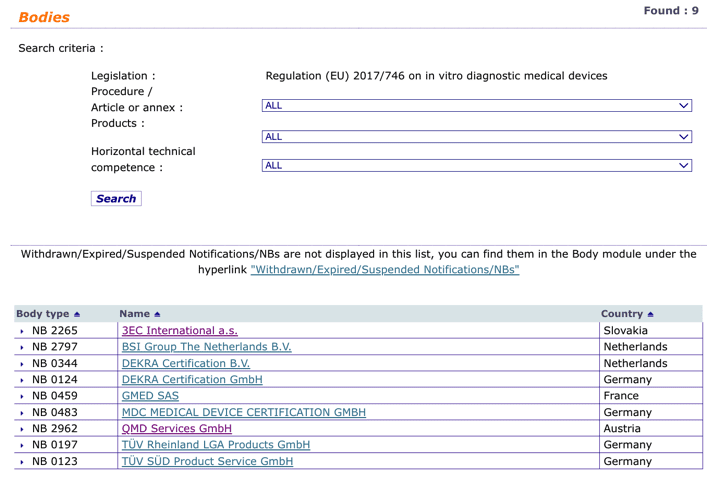
Organismos Notificados MDR (29): TUV NORD Polska (Polonia) ON num. 2274 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
TUV NORD Polska Sp. z o.o
ul. Mickiewicza 29, 40-085 Katowice – Poland
Phone : +48 32 7864646
Email : biuro@tuv-nord.pl
Website : www.tuv-nord.pl
Notified Body number : 2274
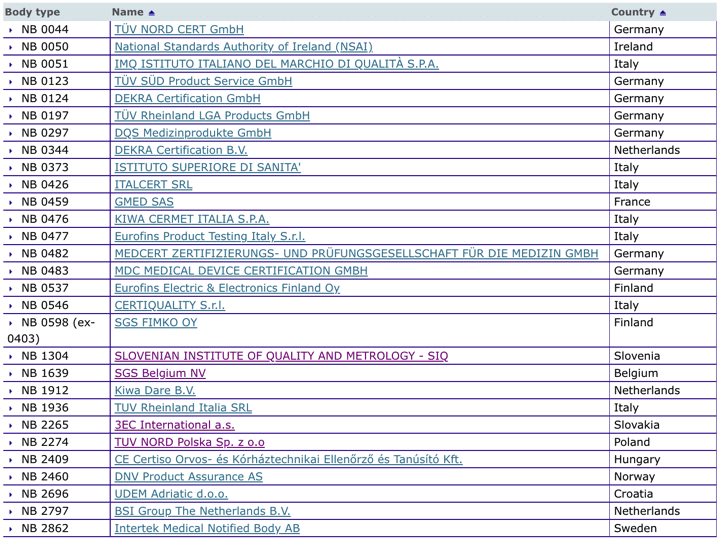
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
y para IVDR …

Exito de @RAPSorg «RAPS 2022 Euro Convergence» celebrado del 10-12 Mayo 2022 Amsterdam
Exito de las jornadas de RAPS https://www.raps.org/europe-2022/home , donde nos pusimos al día con los grandes expertos europeos. Este año en Amsterdam volvió a ser presencial participando representantes de MEDTECH (Fenin Europa), Organismos Notificados, expertos de la Comision Europea y responsables de Regulatory de los grandes fabricantes y por supuesto los consultores.

Congreso SEEIC del 8-10 Junio 2022 @SEEIC_spain con todas las novedades de la Ingeniería Clínica española
La SEEIC Sociedad Española de Electromedicina e Ingeniería Clínica anuncia para los próximos 8 a 10 de junio la celebración de su congreso anual en el Hotel Melia Avenida de America, donde se presentan todas las novedades de la Ingeniería Clínica después de la pandemia que nos ha mantenido focalizados en ayudar a los profesionales sanitarios.
Este año en formato presencial.
Nos vemos en Madrid ![]()

@RAPSorg «RAPS 2022 Euro Convergence» 10-12 Mayo 2022 Amsterdam
Esta semana estamos en la formación de RAPS https://www.raps.org/europe-2022/home , para ponernos al día con los grandes expertos europeos
Este año en Amsterdam volviendo a la presencialidad se celebra esta interesante jornada organizada por la organización RAPS (Regulatory Affairs Profesional Society) en la que participan representantes de MEDTECH (Fenin Europa), Organismos Notificados, expertos de la Comision Europea y responsables de Regulatory de los grandes fabricantes y por supuesto los consultores.
Feliz dia de S. Jordi – 23 de Abril rosa y MDR-IVDR
Congreso mundial esterilización Barcelona 16-19 Nov 2022
https://www.wfhss-congress.com/
Este año con una buena noticia, la celebración del congreso mundial el Barcelona del 16 al 19 de Noviembre de 2022
Dia Internacional de las ciencias de la esterilizacion 10 Abril
Hoy es el dia internacional de las ciencias de la esterilización. Queremos dedicar hoy nuestro aplauso y mandar un abrazo a todos los profesionales que desde los hospitales consiguen que estos sigan funcionando aunque no siempre cuenten con todos los medios.

y este año con una buena noticia, la celebración del congreso mundial el Barcelona del 16 al 19 de Noviembre de 2022

@MedtechEurope ( @FENIN_es ) organiza el Forum #MTF2022 3-5 mayo 2022 Barcelona
No te pierdas el MedTech Forum, este año en Barcelona. Puedes ver su programa aqui
e inscribirte aqui : https://www.themedtechforum.eu/registration-2022

Jornada Productos Sanitarios Seguros by @ABPSegPac 5 Abril 2022 con la participación de @XCanals
Con el subtitulo: «NUEVO REGLAMENTO EUROPEO DE PRODUCTOS SANITARIOS: IMPLICACIÓN LEGAL para la FABRICACIÓN, ADQUISICIÓN, USO SEGURO y REPROCESAMIENTO» .
Tras un año de entrada en vigor del nuevo Reglamento Europeo de Productos Sanitarios:
- ¿Cómo afecta a la legislación de Productos Sanitarios en España?
- ¿Qué oportunidades y qué amenazas supone para la seguridad de los dispositivos médicos?
- ¿Qué debemos tener en cuenta para poder adquirir productos seguros en la contratación pública?
- ¿Nos va a permitir la nueva legislación reprocesar productos de un solo uso?
- ¿Cómo influye en los productos impresos en 3D “in house”?
Para dar respuesta a estas y otras preguntas, organizaremos una jornada presencial de mañana y tarde en la que contaremos con la participación de la Jefa de Departamento de Productos Sanitarios de la Agencia Española de Medicamentos y Productos Sanitarios, Carmen Ruiz Villar, y la Directora Técnica de Fenín, María Aláez, entre otros profesionales de referencia autonómica y nacional expertos en seguridad del paciente, gestión de productos sanitarios, uso seguro, innovación y reprocesamiento. ![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

La @AEMPSgob AEMPS establece el 4 de julio de 2023 como fecha límite para la recuperación de las comunicaciones de PMPS a CCPS
Actualmente, teniendo en cuenta la obligación de mantener actualizadas las comunicaciones, y que los certificados CE tienen un periodo de validez máximo de cinco años, la AEMPS ha determinado que a partir del 4 de julio de 2023 no deberá quedar ninguna comunicación sin recuperar en PMPS. La Agencia, por tanto, solicita a las empresas que procedan a recuperar y actualizar las comunicaciones pendientes en PMPS antes del 4 de julio de 2023. De esta forma, darán cumplimiento a la obligación de comunicación de los productos comercializados en España, de acuerdo con lo previsto en el artículo 22 del Real Decreto 1591/2009, el artículo 10 del Real Decreto 1662/2000 y el artículo 19 del Real Decreto 1616/2009. ![]()

Propuesta modificación Reglamentos: ratificada por el Consejo hoy 7 marzo 2023 para su adopción el 15 marzo 2023
Con la aprobación por el Consejo en la sesión de 7 de marzo 2023 la propuesta de modificación de los Reglamentos MDR e IVDR aprobada con anterioridad por el Parlamento pasa a su adopción formal el próximo 15 de marzo de 2023.
ver notas de prensa:
– Stella Kyriakides Comisaria de Salud y Seguridad Alimentaria
– MEDTECH EU (FENIN)
– COCIR (FENIN)

Propuesta modificación Reglamentos: ratificación por Consejo esperada este martes 7 marzo
Vemos incluida en la sesión del próximo 7 de marzo la propuesta de modificación, para su ratificación sin cambios después de pasar por el Parlamento. En breve podemos tener el texto publicado en el DOUE y al haber eliminado el plazo de 20 días de entrada en vigor será aplicable en su fecha de publicación.
FDA publica la guía para el cumplimiento de la normativa IEC 60825-1 Ed. 3 y IEC 60601-2-22 Ed. 3.1 para equipos Laser @FDAdeviceInfo

Se reactiva el decreto de publicidad de medicamentos y productos sanitarios: PNL 161/4827
Con la presentación de esta proposición no de ley se pretende, como indica en su exposición de motivos, actualizar la legislación española al desarrollo de las tecnologías de la información y la comunicación, la irrupción de las redes sociales y la aparición de nuevos canales de comunicación que plantean nuevos retos en lo que se refiere a la promoción de medicamentos de uso humano y de los productos sanitarios.
Se hace necesaria así el desarrollo de una nueva normativa estatal sobre publicidad de medicamentos, que incluya la regulación también de los productos sanitarios, y que tenga en cuenta los cambios que acarrean los nuevos medios digitales y a los nuevos reglamentos de productos sanitarios.
Organismos Notificados IVDR (10): NSAI (Irlanda) ON num. 0050 nuevo ON. Enhorabuena !!!
Nuevo Organismo Notificado para IVDR núm. 0050:
National Standards Authority of Ireland (NSAI)
1 Swift Square, Northwood, Santry Dublin 9 Ireland
Phone : +353.1.807.38.00
Email : info@nsai.ie
Website : www.nsai.ie
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=35
y para MDR …
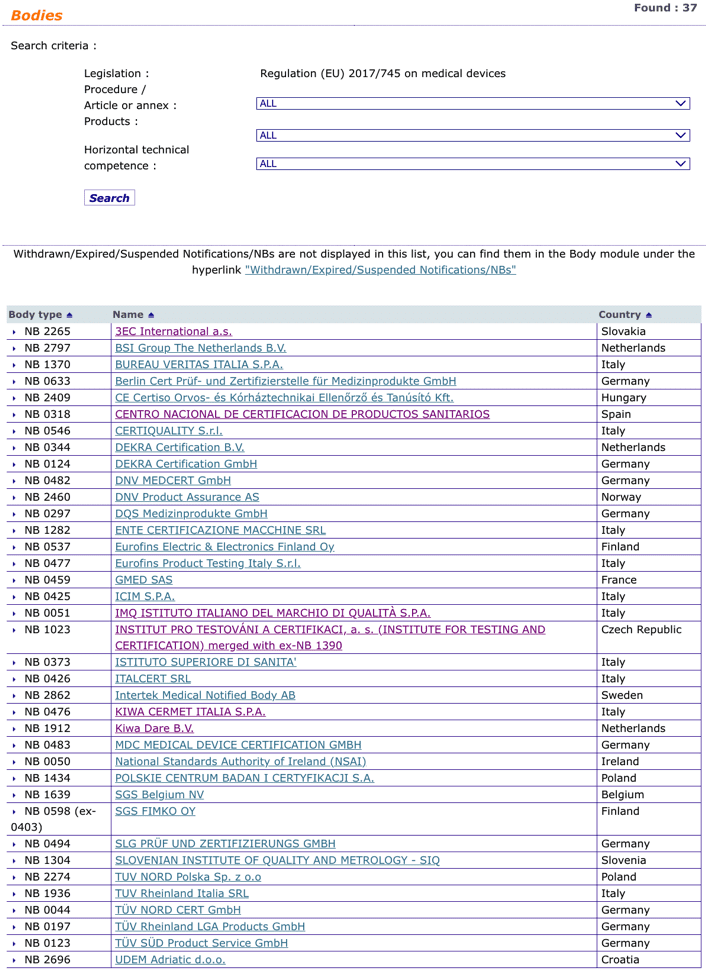
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34

Organismos Notificados IVDR (9): MDC MEDICAL DEVICE CERTIFICATION GMBH (Austria) ON num. 0483 nuevo ON. Enhorabuena !!!
Nuevo Organismo Notificado para IVDR núm. 0483:
MDC MEDICAL DEVICE CERTIFICATION GMBH
Kriegerstrasse 6, 70191 STUTTGART Alemania
Phone : +49:711:253597 0
Email : mdc@mdc-ce.de
Website : http://www.mdc-ce.de
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=35
y para MDR … read more…
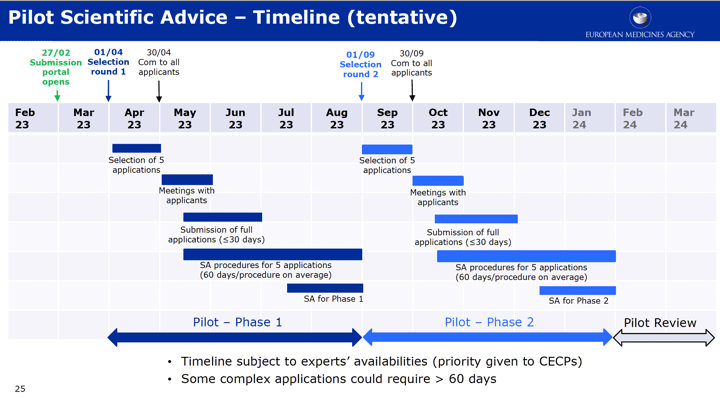
La EMA presenta el piloto de consulta previa de la estrategia de desarrollo clínico para productos sanitarios de alto riesgo – @EMA_news
En este webinar la EMA explicó el piloto establecido para cumplir con el artículo 61.2 de MDR: «Para todos los productos de la clase III y para los productos activos de la clase IIb destinados a administrar y/o retirar medicamentos, el fabricante podrá, antes de su evaluación y/o investigación clínica, consultar a un panel de expertos con el fin de revisar la estrategia de desarrollo clínico prevista por el fabricante y las propuestas de investigación clínica»
Objetivo del proyecto piloto: crear un proceso de SA evaluación científica eficaz para 2024 adaptado a las especificidades del sector de la tecnología sanitaria, que incluya plazos y costes ajustados
Formato del proyecto piloto-Periodo: de febrero de 2023 al 1T de 2024
Solicitantes: fabricantes/representantes autorizados establecidos en la UE
Financiación: sin tasas para los solicitantes durante la fase piloto
Número de procedimientos: 10 SA en 2023 organizadas en 2 rondas de 5 solicitudes
Número limitado para garantizar la disponibilidad de expertos para los CECPs.