PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN

Formación «2305 – Fabricación P.Sanitarios Estériles y Reprocesamiento P. Sanit. DE UN SOLO USO» – 27 JUNIO 2023
Los procesos de fabricación de productos sanitarios estériles (tanto MDR como IVDR) están sujetos a normativas específicas para su validación y rutina que revisaremos para los métodos de esterilización mas relevantes. Además, según el RD 192/2023 y MDR, se permite el reprocesamiento de PS de un solo uso, por lo que veremos este caso especial y las condiciones aplicables según se desarrollan en las especificaciones comunes el nuevo Real Decreto 192/2023 de productos sanitarios y prepararse para el desarrollo legislativo especifico para los Hospitales.
Fecha: 27 Junio 2023, 9h a 14h30 en webinar en directo y 25h en teleformación
Esperamos verte ahi … ![]()
No Results Found
The page you requested could not be found. Try refining your search, or use the navigation above to locate the post.

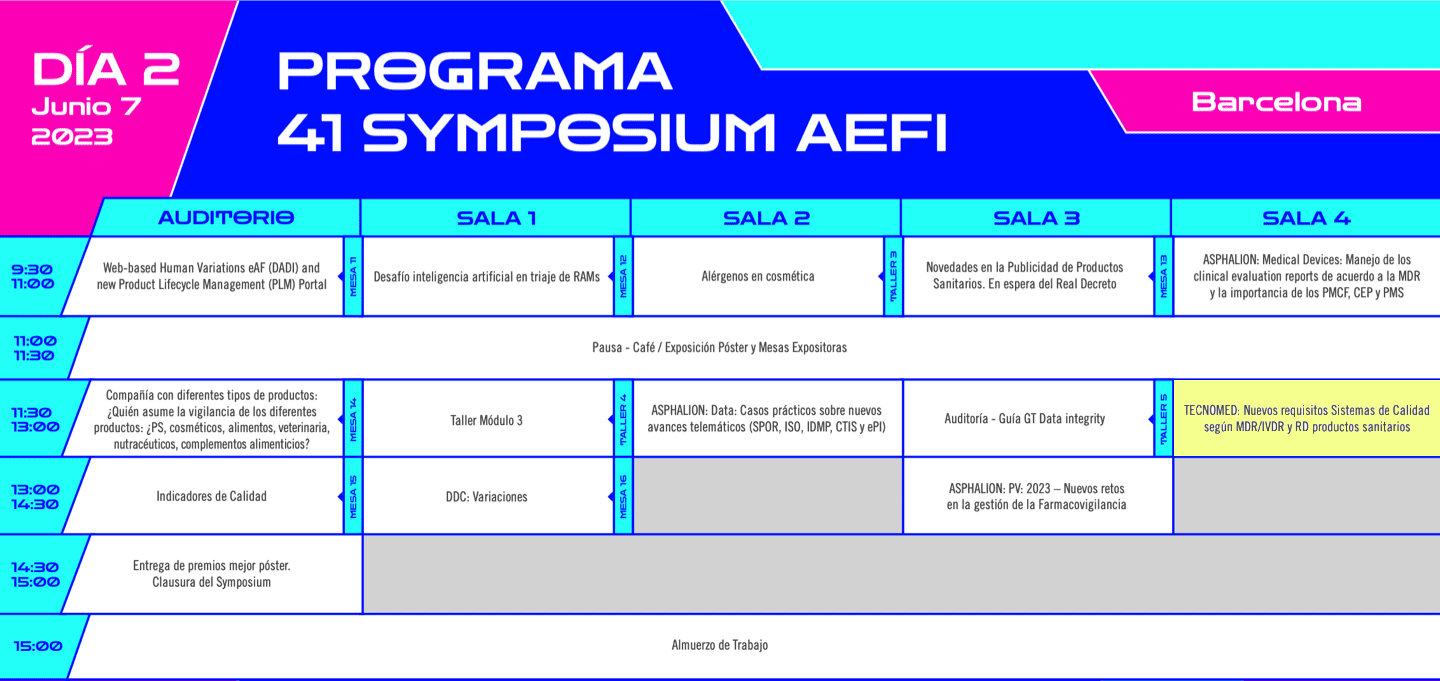
Symposium AEFI 6-7 junio 2023 by @AEFI_es – ven a la presentación del 7 de junio 11h30-13h «Nuevos requisitos Sistemas de Calidad según MDR/IVDR y RD productos sanitarios»

INFORS@LUD by @SEISeSalud 21 a 23 Marzo 2023
Nueva edición del Congreso Nacional de Informática de la Salud de la SEIS que con el lema «Impacto de la Estrategia de Salud Digital del SNS para el avance en el Sistema Sanitario» se celebra en Madrid del 21 al 23 de marzo
Nos vemos allí … ![]()
INFORSALUD es una cita imprescindible para todos los interesados en el sector de las TIC en Salud y en su contribución a la transformación sanitaria para la mejora de la calidad y a la eficiencia de los sistemas sanitarios.
Otra vez encontramos a faltar alguna referencia al nuevo reglamento de productos sanitarios que incluye el software médico y su nueva regla de clasificación 11, específica para el software y también el software in-house (desarrollado por el propio hospital).
Finaliza con éxito el #RMD2023 EAAR Annual Conference on New Medical Device Regulations Bruselas 2-3 Feb 2023
La edición de RMD 2023 finalizó con éxito de participación y contenidos. La conferencia se inició con el reconocimiento a la labor del presidente saliente Mika Reinikainen por parte de la junta y el nuevo presidente de EAAR Ludger Möller y Gideon Elkayam. Visitad la web para las info: https://rmd2023.com/congress-agenda/
Os dejamos aqui algunas fotos:




Exito primera jornada del RMD 2023 EAAR Annual Conference on New Medical Device Regulations Bruselas 2-3 Feb 2023
Ven a estas jornadas donde se abordan los temas mas debatidos de los reglamentos MDR e IVDR por expertos europeos, con la participación de la Comisión Europea, Medtech, EAAR, Qserve, Emergo, Obelis, Axon, Qarad, Informa y Tecno-med.
Claire Murphy presentó en la sesión 2 del 2 de febrero a las 12h el tema de «National Requirements Additional to MDR»
https://rmd2023.com/


Propuesta modificación Reglamentos: avanza su proceso y se prevé su aprobación por el parlamento en el pleno de 13-16 Febrero 2023
La propuesta de modificación de los reglamentos MDR e IVDR avanza en su proceso de codecisión.
nota de prensa en español – factsheet propuesta (eng)
Este es el ultimo documento donde se establecen las fechas
RMD 2023 EAAR Annual Conference on New Medical Device Regulations Bruselas 2-3 Feb 2023 con la participación como ponente de @CMurphy_tmi de @tecno_med
Ven a estas jornadas donde se abordan los temas mas debatidos de los reglamentos MDR e IVDR por expertos europeos, con la participación de la Comisión Europea, Medtech, EAAR, Qserve, Emergo, Obelis, Axon, Qarad, Informa y Tecno-med.
Claire Murphy presentará en la sesión 2 del 2 de febrero a las 12h el tema de «National Requirements Additional to MDR»![]()

La Unión Europea acoge la reunión anual de IMDRF 27-28 Marzo 2023

Barcelona Cybersecurity Congress – sesión de ciberseguridad en Sanidad
Interesante sesión especifica poniendo el foco en el paciente …
https://www.barcelonacybersecuritycongress.com/

Symposium AEFI 6-7 junio 2023 by @AEFI_es

INFORS@LUD by @SEISeSalud 21 a 23 Marzo 2023
Formacion ‘Productos sin finalidad médica: marcado CE según nuevo Reglamento’ 18 enero 2018 BCN
El Reglamento (UE) 2017/745 (MDR) (en vigor desde 26 de mayo de 2017) amplía el campo de aplicación de la reglamentación de productos sanitarios para incluir también determinados productos sin finalidad médica. Estos productos que se enumeran en el anexo XVI incluyen equipos de electroestética (láser – IPL de depilación, equipos de liposucción, equipos adelgazamiento, …) productos de medicina estética (sustancias de relleno mediante inyección subcutánea, implantes mamarios, …) u otros que por su riesgo potencial se han incluido (lentes de contacto sin finalidad correctora, equipos de estimulación cerebral,…). En esta jornada, vemos las posibles estrategias y oportunidades de mercado, revisamos los pasos a dar para su cualificación dentro del ámbito del MDR, su clasificación de acuerdo a las reglas de clasificación renovadas y su evaluación de conformidad mediante la revisión de la documentación técnica disponible y el uso de la normativa de calidad EN ISO 13485:2016.
![]() read more…
read more…
Formacion ‘Productos sin finalidad médica según nuevo Reglamento’ 18 enero 2018 BCN
El Reglamento (UE) 2017/745 amplia el campo de aplicación de la reglamentación de productos sanitarios para incluir también determinados productos sin finalidad médica. Estos productos incluyen equipos láser de depilación, equipos liposucción, lentes de contacto, sustancias de relleno mediante inyección subcutánea o equipos de estimulación cerebral. En esta jornada revisamos los pasos a dar para su cualificación, clasificación y evaluación de conformidad ISO 13485 así como la documentación técnica para la obtención del marcado CE.![]()
EXITO FORMACION ‘Marcado CE productos sanitarios según nuevos Reglamentos’ – GRACIAS!!!

Con mas de 80 inscritos entre presencial y web finaliza la formación que hacemos desde hace mas de 20 años …
MUCHAS GRACIAS !!!
Formacion ‘Marcado CE productos sanitarios según nuevos Reglamentos’ 30 nov 2017 BCN
Ven a esta formación que hacemos desde hace mas de 20 años …
Este año en esta formación revisaremos los requisitos para la obtención del marcado CE como producto sanitario según los nuevos reglamentos (EU) 2017/745 MDR y (EU) 2017/746 IVDR.
30 de Noviembre de 2017, de 10h a 18h – Parque Tecnológico BCN – C/ Marie Curie nº 8 – 08042 Barcelona
Reserva la fecha para ponerte al día e inscríbete![]()
hay mas formaciones, mira si en alguna te llevas los siguientes documentos al salir de la formación
Formacion ‘Requisitos agentes económicos (fabricante, EU-REP, importador y distribuidor) según nuevos Reglamentos’ 19 oct 2017 BCN @Tecno_Sanitaria
Se revisarán los requisitos de los agentes económicos que no son el fabricante de los productos sanitarios, como distribuidores, importadores, agrupadores, esterilizadores, servicios de asistencia técnica, hospitales fabricantes in house, fabricantes virtuales (OBL), reprocesadores y fabricantes de productos sanitarios a medida según los nuevos reglamentos (EU) 2017/745 y (EU) 2017/746. read more…
Formación “Jornada monográfica Directiva RED (2014/53/EU)” @GCEM_UPC 10 Oct 2017

Nuestros colegas del Grupo de Compatibilidad Electromagnética de la UPC preparan una formación sobre la nueva directiva RED (2014/53/EU) que pensamos puede ser de interés para fabricantes de equipos electromédicos que incluyan wifi o bluetooth y que quieran conocer los requisitos de esta nueva directiva que sustituye a la directiva RTTE a partir de junio de 2017. Inscríbete ya !!
Formacion ‘apps de salud vs apps de bienestar’ 28 sept 2017 BCN
En esta formación revisaremos su cualificación como productos sanitarios, clasificación, diseño, documentación y validación para obtener su marcado CE como producto sanitario con los nuevos reglamentos o establecer su no aplicación al no cualificarse como tal. Como novedad relevante el nuevo reglamento (EU) 2017/745 tiene una regla de clasificación (11) especial para el software por la que muchos softwares medicos / apps de salud pasan a ser de clase IIa, IIb e incluso III.
28 de Septiembre de 2017, de 10h a 18h – Parque Tecnológico BCN – C/ Marie Curie nº 8 – 08042 Barcelona
Reserva la fecha para ponerte al día e inscríbete![]()
read more…
Programa Formación 2018 de @Tecno_Sanitaria
Exito Jornada 21 Julio Formación Reglamentos (UE) 2017/745 y 746 sobre Productos Sanitarios Bilbao
Exito Jornada Formación Reglamentos (UE) 2017/745 y 6 sobre Productos Sanitarios – Valencia

Muchas gracias a todos por vuestra asistencia y a ASIVALCO por dejarnos usar sus magnificas instalaciones de Paterna
Valencia 14 de Julio de 2017 “Nuevos Reglamentos MDR + IVDR” 

@MHRAdevices publica la planificación del «Programa de Cambio del Software y AI con consideración de producto sanitario»
En esta publicación la autoridad sanitaria de Reino Unido establece los pasos para su plan para la evaluación del software, que incluye los siguientes grupos de tareas:
WP 1 Qualification
WP 2 Classification
WP 3 Premarket requirements
WP 4 Post Market
WP 5 Cyber Secure Medical Devices
WP 9 AI RIG (AI Rigour)
WP 10 Project Glass Box (AI Interpretability)
WP 11 Project Ship of Theseus (AI Adaptivity)
Lo seguimos de cerca pues aunque ya no pertenecen a la UE, sus técnicos siguen siendo referentes para Europa
Descargue el documento aqui:![]()

La EMA @EMA_news publica la revisión de consultas por los ON relativas a productos sanitarios con medicamentos
Nuevas tasas de FDA para medical devices de FY2024 @FDAdeviceInfo

Estas son las tasas para Fiscal Year 2024 (FY2024) que va de 1/Oct/2023 hasta 30/Sept/2024
Primera licencia de la AEMPS para productos de anexo XVI @AEMPSgob

Publicado por SWISSMEDIC una Guia de Reprocesado de Productos Sanitarios (excluyendo los ps de un solo uso)
La legislación suiza que regula el reprocesado de los productos sanitarios es la MedDO Medical Device Ordinance. Está prohibido reprocesar y reutilizar los productos de un solo uso usados. Sin embargo, los productos de un solo uso no utilizados suministrados en condiciones no estériles pero destinados a un uso estéril deben reprocesarse de conformidad con las instrucciones del fabricante antes de su uso, según establece el artículo 73 de la MedDO. También está prohibido utilizar o distribuir productos de un solo uso que hayan sido reprocesados en el extranjero.
Esta guia establece pues las directrices para la validación de estos procesos de reprocesado de productos sanitarios reutilizables. ![]()

Primera licencia de la AEMPS para fabricante a terceros de productos sanitarios @AEMPSgob

Factsheet – Ficha informativa para Autoridades Sanitarias países no pertenecientes a la UE

Boletin @AEMPSgob 2T 2023 de productos sanitarios

@MedtechEurope ( @FENIN_es ) publica un modelo de «Manufacturer’s Declaration» a emitir por el fabricante para indicar la aplicación de la prorroga del reglamento 2023/607 a sus productos
Nos encanta tener razón, jajaja. Esto era lo que recomendábamos en nuestras formaciones y ahora la Comisión Europea publica este modelo de Declaración del Fabricante en la que el fabricante declara cumplir los requisitos para poder aplicar la prorroga de los periodos transitorios
Descargue el documento aqui:![]()