PRODUCTOS SANITARIOS


.
REGLAMENTO MDR (EU) 2017/745
MDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2021
RD 192/2023
RD – ingles
entrada en vigor: 23 marzo 2023
«legacy» s/reglamento 2023/607
IIb(implante) y III -31 dic 2027
IIa, IIb(no implant) y I (ON) -31 dic 2028
sin fin periodo distribución
.
PRODUCTOS SANITARIOS IVD


.
REGLAMENTO IVDR (EU) 2017/746
IVDR – ingles
entrada en vigor: 26 mayo 2017
fecha aplicación: 26 mayo 2022
RD IVD
entrada en vigor: 2024?
«legacy»s/reglamento 2024/1860
clase D – 31 Dic 2027
clase C – 31 Dic 2028
clases B y As – 31 Dic 2029
sin fin periodo distribución
.
PROXIMA FORMACIÓN
Formación «2401 – SOFTWARE MÉDICO e INTELIGENCIA ARTIFICIAL» – 18 En 2024 9h-14h con las novedades normativas y de guías
Este diciembre se aprobó el texto de la AIA Artificial Intelligence Act que incluye al software médico con IA como crítico y también diversas normas asociadas a las aplicaciones informáticas médicas que incluyen IA, como la ISO/IEC 42001 sistema gestión AI, la BSI AAMI 34971 riesgos AI, … por la ISO/IEC JTC 1/SC42
Y también tenemos las actualizaciones de las guías de documentación técnica de software de Team-NB, de FDA y de IG-NB …
Las aplicaciones de software médico y las aplicaciones de software que incluyen inteligencia artificial han provocado un avance disruptivo en los diagnósticos y tratamientos sanitarios. En esta formación revisamos sus requisitos como producto sanitario incluyendo la nueva normativa asociada a interoperabilidad, ciberseguridad, integridad de datos y protección de datos.
Fecha: 18 Enero 2024, 9h a 14h en webinar en directo y 25h en teleformación
Esperamos verte ahi … ![]()
Termina IDS 2017 la feria por excelencia del sector dental – 21 a 25 de Marzo Colonia (Alemania)
Con 52 stands españoles (de un total de 2300 de 60 países) representando uno de los sectores mas punteros en productos sanitarios del país, como cada 2 años han presentado sus novedades en la feria mas importante del mundo. Con mas de 140.000 visitantes esta feria es como la de Medica un desafío para los fabricantes que se “miden” frente a sus clientes. El próximo … 12 a 16 marzo 2019 (da gusto la organización alemana). read more…
Feria @Arab_Health 30 Enero a 2 Febrero 2017
Como cada año vuelve ArabHealth que se ha consolidado como verdadera competencia de la MEDICA y de la que los expositores vuelven siempre contentos,
Este año con 57 stands españoles …
Resumen de la MEDICA 14-17 Nov 2016 @MEDICAtradefair
MEDICA 14-17 Nov 2016 @MEDICAtradefair – ven al @Fenin_es “networking breakfast” participa @tecno_med
FENIN organiza como cada año sus sesiones de “NETWORKING BREAKFAST” en la que participamos contando las novedades de la ISO 13485:2016


 read more…
read more…
@FENIN_es Mision comercial a Australia
Feria FIME 2016 2 a 4 Agosto Miami USA
Este año con los stands españoles:
Inmoclinc SA Stand No.: D.E39
Lessa-AB Medica Group, S.A. Stand No.: D.E33
Medicare System Stand No.: D.K25
Ordisi SA Stand No.: D.D40
Orliman Stand No.: D.D32
Osatu S Coop Stand No.: D.E35
RADIOLOGIA S.A Stand No.: D.E37
Surgival Stand No.: D.D36
Tecnilatex SA Stand No.: D.D34
Vesismin SL Stand No.: D.D38 read more…

Curso de la Asociación de Buenas Practicas en Seguridad de Pacientes @ABPSegPac «SEGURIDAD Y OPTIMIZACIÓN DE PROCESOS EN LA UNIDAD DE REPROCESAMIENTO DE DISPOSITIVOS MÉDICOS HOSPITALARIA» 26, 27 y 28 Oct’2023 Oviedo con la participación de @Tecno_med
Organizado por el Servicio de Esterilización Area IV SESPA y la Asociación de Buenas Practicas en Seguridad de Pacientes en Oviedo del 26 al 28 de Oct’2023 con el objetivo de capacitar a los participantes a comprender los principales factores a tener en cuenta para un proceso seguro en las RUMED y proporcionar una metodología y herramientas para realizar un análisis del circuito del instrumental quirúrgico y lograr un flujo de trabajo estructurado y eficiente cumpliendo los nuevos requisitos del reglamento y RD de productos sanitarios.
Ya esta abierta la inscripción (150 Eur)![]()
Participamos en. la mesa: 26 Oct 16h50 – RD 192/2023. Nuevas oportunidades, nuevos requisitos Claire Murphy y Xavier Canals – Tecno-med Ingenieros Consultores Tecnologías Sanitarias
ver programa read more…

@ENISA_eu publica un informe sobre incidentes de ciberseguridad en el sector sanitario
El informe elabora una revisión de los ciberincidentes en Europa durante 2021 a 2023, siendo España el 2º país mas acosado después de Francia. Ver informe completo

@RSNA 2023: USA Chicago #RSNA23 del 26-30 Nov
La mayor feria de imagen médica abre como cada años sus puertas en Chicago. Mucha suerte a los participantes!!!
Esta es la web: https://www.rsna.org/Annual-Meeting
seguiremos informando …

Jornada 4 oct’23 10h-14h «REGLAMENTO EUROPEO 2017/746 Y REGULACIÓN NACIONAL PARA TECNOLOGÍAS DE DIAGNOSTICO IN VITRO: FABRICACIÓN IN HOUSE» by @FENIN_es
No os perdáis esta jornada que realiza FENIN en colaboración con ICS en su sede (Gran Via de les Corts Catalanes, 587, Barcelona) donde se revisan los requisitos del reglamento IVDR. Para ello FENIN ha organizado este evento contado por ponentes de: FENIN, AEMPS, ENAC.
Nos vemos allí. Inscribiros aqui:![]()

LABCLIN 2023 Zaragoza 18 a 20 Octubre 2023 @congresolabclin
Organizado por las tres sociedades científicas de laboratorio (AEBM-ML, AEFA y SEQC), este año https://www.labclin2023.es/ en Zaragoza con unos 1400 participantes y más de 25 empresas del sector. read more…

Europa acogerá las reuniones de IMDRF International Medical Devices Regulators Forum en Berlin 25-26 Septiembre 2023
La Comisión Europea abre una pagina web para las reuniones del IMDRF cuya presidencia ocupa EU el 2023. Como sabéis el IMDRF es la organización que se ocupa de la armonización de las legislaciones a nivel mundial para productos sanitarios.
nos vemos allí ….
DIA 1 – 25 September 2023
Joint IMDRF / Stakeholder (DITTA-GMTA) Workshop – Specialized Regulatory Pathways
– Opening remarks
– Scene setter – overview of IMDRF foundational pathways
– Devices intended for specific patient populations
– Panel discussion – lessons learned and opportunities for improvement
– Innovative medical devices
– Regulatory toolboxes to foster innovation
DIA 2: 28 Mazo 2023 IMDRF Stakeholder Forum
– Regulatory updates from IMDRF Management Committee and Official Observers including short updates from IMDRF Working Groups
– Regulatory updates from IMDRF Management Committee and Official Observers including short updates from IMDRF Working Groups
– Stakeholders sessions
– Flash panel – exchange of experience and best practices
– Closing remarks read more…

Congreso @CASEIB2023 de la SEIB Sociedad Española Ingenieria Biomedica 22-24’Nov 2023 Cartagena by @SEIB_twit
La SEIB Sociedad Española de Ingeniería Biomédica celebró su Congreso anual https://caseib.es/2023/, en Cartagena del 22 al 24 de noviembre de 2023.
Nos vemos allí. Inscribete en la pagina web del congreso![]()

@WFHSScongress anuncia el Congreso mundial esterilización Bruselas 18-21 Oct 2023 y actualiza su programa
Congreso mundial en Bruselas del 18 al 21 de Octubre de 2023 https://www.wfhss-congress.com/
Este año si incluye reprocesado de productos sanitarios de un solo uso y como no IA, ponemos aqui las ponencias que nos llaman la atención:
19 Oct
08.45 – 09.30 CONFERENCE 1 Artificial Intelligence in the Medical world
10.00 – 10.30 CONFERENCE 3 Safety, cost and environmental effects of reprocessing single use medical devices: systematic review and meta-analysis Niam Mcgrath
20 Oct
09.00 – 09.30 CONFERENCE 12 Hospital Sterilization of 3D Printed Devices Randal Eveland (United States)
11.45 – 12.15 CONFERENCE 16 Alignment of global medical device standards and their acceptability for regulatory purposes Richard Bancroft (United Kingdom)
14.30 – 15.00 CONFERENCE 19 Surgical Instrument traceability in sterilization: legal obligation or necessity? Olivier Willième (Belgium)
![]()

Europa acogerá las reuniones de IMDRF International Medical Devices Regulators Forum en Berlin 25-26 Septiembre 2023
La Comisión Europea abre una pagina web para las reuniones del IMDRF cuya presidencia ocupa EU el 2023. Como sabéis el IMDRF es la organización que se ocupa de la armonización de las legislaciones a nivel mundial para productos sanitarios.
nos vemos allí …. read more…

La HPRA ofrece la elaboración de Certificados de libre venta para los productos legacy bajo el reglamento de extensión 2023/607
MUCHAS GRACIAS !! Jornada formacion @Tecno_Sanitaria «P.SANITARIOS DE AUTO-CERTIFICACIÓN y LEGACY – CUMPLIMIENTO MDR» 23 Enero BCN
MUCHAS GRACIAS !!! Jornada formacion @Tecno_Sanitaria «P.SANITARIOS DE AUTO-CERTIFICACIÓN y LEGACY – CUMPLIMIENTO MDR» – Madrid
Publicado Catalogo formacion @AENOR 2020 «Implantación y auditoria de la UNE EN ISO 13485:2018» con la participación de @tecno_med
Ven a esta formación de 2 días (9h a 18h) para empaparte del sistema de calidad que deben mantener todos los actores del sector de tecnologías sanitarias: fabricantes, importadores, distribuidores, instaladores, mantenedores, centrales de esterilización y servicios de electromedicina. Prepárate para los nuevos reglamentos MDR e IVDR
Esperamos veros allí …
Objetivos
– Familiarizarse con los nuevos reglamentos europeos de productos sanitarios (EU) 2017/745 y 2017/746 que están en vigor desde 25 de mayo de 2017.
– Comprender la importancia de gestionar la calidad en las organizaciones de productos sanitarios, su implantación y auditoría.
– Analizar los requisitos de la Norma ISO 13485. Productos Sanitarios. Sistemas de gestión de la calidad. Requisitos para fines reglamentarios incluyendo los requisitos de los reglamentos europeos.
– Prepararse para la realización de auditorías internas del sistema de gestión ISO 13485
Contenidos
1. Los productos sanitarios. Delimitación del concepto
2. Legislación sobre productos sanitarios MDR e IVDR
3. Clasificación de los productos sanitarios. Rutas de evaluación de conformidad
4. La Norma ISO 13485 y su guía de aplicación. Análisis de requisitos punto a punto
5. Puntos críticos: Gestión de riesgos y Control cambios de sistema y de producto. Validación software calidad, fabricación e instrumentación de medida. Vigilancia. Retroalimentación PMS. Casos prácticos
6. La implantación de un sistema de gestión de la calidad en organizaciones de productos sanitarios. Planes adaptación.
7. Auditoría interna y de proveedores cruciales y subcontratistas críticos según la Norma ISO 13485
8. Futuros cambios de la norma: MDSAP, adaptación a esquema HL, …
9. Casos prácticos
Profesores: Claire Murphy y Xavier Canals
¿Qué es un «cambio significativo» en el diseño y finalidad prevista? ¿cuales son los requisitos de PMS, vigilancia y registro de agentes económicos y de productos según MDR?
¿Qué es un cambio significativo? Esta es una de las cuestiones mas relevantes para tomar la decisión de cuando aplicar MDR los productos «legacy» (con certificado válido según la directiva) o los clase I que pasan a tener intervención de un Organismo Notificado con MDR.
Formacion online @Tecno_Sanitaria «Gestión de Riesgos de Productos Sanitarios – según ISO 14971:2019 y MDR/IVDR»

En febrero pondremos a vuestra disposición este curso de actualización, encontrarás estrategias para la realización de informes de gestión de riesgos de producto según la nueva edición de la norma EN ISO 14971:2019 y los nuevos reglamentos y como integrarlo en nuestro sistema de gestión de la calidad y documentación técnica de una familia de productos sanitarios.
Jornada formacion @Tecno_Sanitaria «P.SANITARIOS DE AUTO-CERTIFICACIÓN y LEGACY – CUMPLIMIENTO MDR»
Después de que se aprobara el Corrigendum 2 del Reglamento de MDR nos han quedado menos productos sanitarios en cuenta atrás pero no podemos bajar la guardia. read more…
Gracias por vuestra participación en las Jornadas Dic 2019 Formación Reglamentos (UE) 2017/745 MDR y (UE) 2017/746 IVDR
Ya está cerca el fin del periodo transitorio para el reglamento MDR de productos sanitarios 26 de mayo de 2020. Estamos preparando unas jornadas de formación que pensamos pueden ser de tu interés:
1907. IVDR – ADAPTACION – MARCADO CE P.SANITARIOS IVD (ADAPTACION) SEGUN REGLAMENTO (EU) 2017/746
1907A. MDR – ADAPTACION – MARCADO CE P.SANITARIOS (ADAPTACION) SEGÚN REGLAMENTO (EU) 2017/745
Proximamente disponibles en version ONLINE
Jornadas Dic 2019 Formación Reglamentos (UE) 2017/745 MDR y (UE) 2017/746 IVDR
Ya está cerca el fin del periodo transitorio para el reglamento MDR de productos sanitarios 26 de mayo de 2020. Estamos preparando unas jornadas de formación que pensamos pueden ser de tu interés:
1907. IVDR – ADAPTACION
- MADRID 11 DIC 2019
1907A. MDR – ADAPTACION
- BARCELONA 17 DIC 2019
Esperamos contar con tu presencia. Gracias por tu confianza, nos vemos en las jornadas
@FENIN_es nos informa de esta jornada: «Reglamento Europeo 2017/745 sobre los productos sanitarios: Mas allá del mero cumplimiento normativo»
Jornada «Vigilancia de Productos Sanitarios MDR» Madrid 6 Nov 2019 Madrid by @AEFI_es con la participación de Claire Murphy @tecno_med

El curso que es una nueva edición del que se realizó con éxito en Madrid y Barcelona y pretende abordar de forma global y práctica los aspectos principales relacionados con la gestión de la vigilancia de los productos sanitarios según el nuevo reglamento. read more…
@MedtechEurope ( @FENIN_es ) publica el informe «Europe’s recommendations ahead of May 2025 deadline for Class D IVDs»
Felices Navidades !!! os deseamos desde @tecno_med
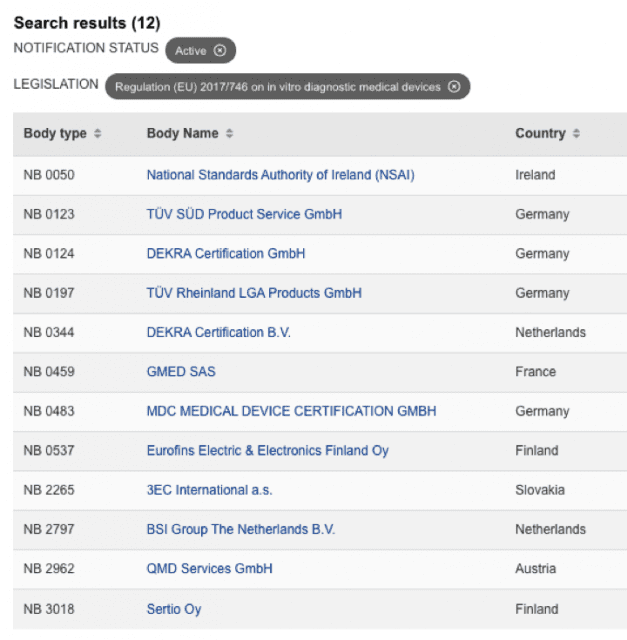
Organismos Notificados: Estado del proceso de designación 42 ON para MDR y 12 ON para IVDR
BREXIT: TUV SUD BABT amplia a clase III como UKAB (UK approved bodies) para productos sanitarios
- TUV SUD BABT Unlimited (0168) – MD
Estos son las entidades de evaluación de conformidad:
- BSI Assurance UK Ltd (0086) – MD – AIMD – IVDD
- DEKRA Certification UK Ltd (8505) – MD
- SGS United Kingdom Ltd (0120) – MD – IVDD
- UL International (UK) Ltd (0843) – IVDD
- TUV Rheinland UK Ltd (2571) – MD – IVDD
- TUV SUD BABT Unlimited (0168) – MD
- INTERTEK MEDICAL NOTIFIED BODY UK Ltd (8532) – MD
ver la lista y alcances en la pagina de MHRA
Organismos Notificados MDR (43): CMI – CESKY METROLOGICKY INSTITUT (Republica Checa) ON num. 1383 nuevo Organismo Notificado. Enhorabuena !!!
Nueva designación del Organismo Notificado:
CSI CESKY METROLOGICKY INSTITUT
Dirección: Okruzni 31 638 00 BRNO
Email : rcmi@cmi.cz
Website : www.cmi.cz
puedes ver la lista siempre actualizada en la base de datos NANDO:
https://webgate.ec.europa.eu/single-market-compliance-space/#/notified-bodies/notified-body-list?filter=legislationId:34,bodyTypeId:3,notificationStatusId:1
y para IVDR …
lista actualizada IVDR en:
https://webgate.ec.europa.eu/single-market-compliance-space/#/notified-bodies/notified-body-list?filter=legislationId:35,bodyTypeId:3,notificationStatusId:1
Publicada la norma ISO/IEC 42001:2023 Tecnología de la información. Inteligencia artificial. Sistema de Gestión by @ISOstandards @IECstandards @normasUNE
Interesante esta publicación que esta dirigida a AI general no sólo a las médicos, que debería aplicarse en conjunción con la ISO 13485, la EN 62304 y EN 82304 además de las especificas de AI . Esta norma proporciona los requisitos para establecer, implantar, mantener y mejorar continuamente un sistema de gestión de la IA en el contexto de una organización. Ciertas características de la IA, como la capacidad de aprender y mejorar continuamente o la falta de transparencia o explicabilidad, pueden justificar la adopción de medidas de protección diferentes si plantean problemas adicionales en comparación con la forma en que se realizaría tradicionalmente la tarea. Las necesidades y los objetivos, los procesos, el tamaño y la estructura de la organización, así como las expectativas de las distintas partes interesadas, influyen en el establecimiento y la aplicación del sistema de gestión de la IA. Otro conjunto de factores que influyen en el establecimiento y la aplicación del sistema de gestión de la IA son los numerosos casos de uso de la IA y la necesidad de encontrar el equilibrio adecuado entre los mecanismos de gobernanza y la innovación. Las organizaciones pueden optar por aplicar estos requisitos utilizando un enfoque basado en el riesgo para garantizar que se aplica el nivel adecuado de control para los casos de uso, servicios o productos de IA particulares dentro del ámbito de la organización. Se espera que todos estos factores de influencia cambien y se revisen cada cierto tiempo. Este documento proporciona directrices para el despliegue de controles aplicables para apoyar dichos procesos.
El sistema de gestión de la IA proporciona requisitos específicos para gestionar los problemas y riesgos derivados del uso de la IA en una organización. Este enfoque común facilita la aplicación y la coherencia con otras normas de sistemas de gestión, por ejemplo, las relacionadas con la calidad, la seguridad, la protección y la privacidad.
Ámbito de aplicación
Este documento especifica los requisitos y proporciona orientación para establecer, implementar, mantener y mejorar continuamente un sistema de gestión de IA (inteligencia artificial) en el contexto de una organización. Este documento está destinado a ser utilizado por una organización que proporcione o utilice productos o servicios que utilicen sistemas de IA. Este documento pretende ayudar a la organización a desarrollar, proporcionar o utilizar sistemas de IA de forma responsable en la consecución de sus objetivos y a cumplir los requisitos aplicables, las obligaciones relacionadas con las partes interesadas y las expectativas de éstas. Este documento es aplicable a cualquier organización, independientemente de su tamaño, tipo y naturaleza, que proporcione o utilice productos o servicios que utilicen sistemas de IA.
Respuesta de la industria @MedTechEurope , … a la petición de diversas autoridades sanitarias en el Consejo EPSCO (Ministerios Sanidad Europeos) pidiendo el uso forzoso de EUDAMED
Como respuesta a la petición en la EPSCO relativa a la puesta en marcha urgente de EUDAMED y la obligatoriedad de su uso por los fabricantes la industria europea; la industria ha realizado esta comunicación en la que indica:
» …
En la reunión del Consejo de EPSCO celebrada el 30 de noviembre de 2023, varios Ministros de Sanidad pidieron la pronta disponibilidad obligatoria de la base de datos europea de productos sanitarios (EUDAMED). Las asociaciones industriales firmantes destacan importantes condiciones previas que son necesarias antes de que cualquier módulo de EUDAMED sea obligatorio:
1.Que los módulos estén completamente desarrollados, probados, auditados y listos para su aplicación práctica.
2.Que EUDAMED permita el uso más eficiente de los recursos de los Organismos Notificados y de los Fabricantes.
3.Que se proporcionan plazos de aplicación y transición realistas y fiables.
4.Que se elimine la redundancia en las bases de datos nacionales.
…»
MDCG: publicada nueva MDCG 2023-5 Guia de cualificación y clasificación de productos de Anexo XVI
Esta guía establece un repaso de como cualificar un producto como de Anexo XVI y en su caso los accesorios, y después como clasificarlos. Interesantes los ejemplos …
Grupo 1 – Lentes de contacto (sin fin medico)
clase IIa – regla 5 – Todos los productos invasivos con respecto a los orificios corporales, distintos de los productos invasivos quirúrgicos, que no estén destinados a conectarse a un producto activo o que estén destinados a conectarse a un producto activo de la clase I se clasifican en: clase IIa si están destinados a un uso de corto plazo …
Ejemplos:
– Lentes de contacto de color no correctoras de uso a corto plazo
– Lentes de contacto no correctoras de uso a corto plazo con impresiones
Grupo 3 Sustancias destinados a ser utilizados para el relleno
clase IIb – Regla 8 Todos los productos implantables y los productos invasivos quirúrgicos de larga duración se clasifican en la clase IIb … o
clase III – si es absorbida
clase III – Regla 14 incorpora producto medicinal …
Ejemplo:
IIb – (Reg.8) Rellenos dermatológicos permanentes
III – (Reg. 8) Rellenos dermatológicos reabsorbibles; productos de masoterapia para relleno
III – (Reg.14) Rellenos que incorporan anestesicos
Grupo 4 productos para liposucción, lipólisis y lipoplastia
Ejemplos:
Clase I – Regla I – tubos conexión
– Regla 6 – Canulas reutilizables
Clase IIa – Regla 6 – Canulas
Clase IIb – Regla reglamento 2022/2347 – Lipoplastia asistida por succión (SAL)- Lipoplastia asistida por potencia (PAL)- Bombas de succión- Equipos para criolipólisis
Grupo 5 productos laser, IPL, RF, … tratamiento dermico
Ejemplos
Clase IIa – Regla reglamento 2022/2347 – Equipo laser/led/IPL para depilación
Clase IIb – Regla reglamento 2022/2347 – Equipos láser para depilación, rejuvenecimiento cutáneo, eliminación de tatuajes, cicatrices hipertróficas y queloides, mejora de problemas de pigmentación (por ejemplo, daño solar, manchas de la edad), mejora del aspecto de lesiones vasculares- Equipos IPL para depilación, rejuvenecimiento cutáneo, mejora de problemas de pigmentación (por ejemplo, daño solar, manchas de la edad), mejora del aspecto de lesiones vasculares- Equipos LED para rejuvenecimiento cutáneo, estimulación del crecimiento del vello, mejora del aspecto de cicatrices de acné (por ejemplo: mascarillas faciales LED).